药用胶塞供应商质量审计如何实施,你了解吗?
前言
药包材对于保证药品的安全性、有效性起着重要的作用,药用胶塞是药用内包装系统中的重要组成部分,直接接触各类药品,对保证药品稳定性起决定性作用,不适宜的胶塞可能会引起药物成分的渗出、吸附甚至失效,本文为大家梳理了药用胶塞供应商质量审计实施关键点,可供药品生产企业开展药用胶塞供应商质量审计提供参考。
一 药用胶塞供应商质量审计如何做
1、供应商质量审计流程
物料采购是生产的第一环节,在不良的条件下生产的胶塞,会影响药品的质量,受到污染的药品一旦流入市场,可能会危及患者的生命,造成严重危害。因此要保证药品的质量, 必须严格控制直接接触药包材的药用胶塞的高质量水平,增强对药用胶塞生产厂家的质量体系进行现场质量审计。药用胶塞供应商质量审计建议参考下图《供应商审计流程图》进行。

2、供应商质量审计组成员确认
药企应组织有资格的人员组成质量审计组开展质量审计活动,具有相关的法规和专业知识,具有足够的质量评估和现场质量审计的实践经验和能力,审计组成员一般由质量管理、生产管理、供应链管理、技术管理等部门人员组成,一般为 2~5 人为宜, 并确认审计组组长, 审计时对审计活动负全责,审计组组长的职责包括:
a)编制审计计划;
b)审计组内部沟通以及与受审计方的沟通;
c)编写审计报告
d)整改情况的推进
3、制定供应商质量审计计划
供应商质量审计计划一般由药企的质量管理负责人批准。根据已被批准的“供应商质量审计计划”,供应链部人员提前书面通知到审计组成员和受审计方(胶塞生产供应商)。
审计计划的内容应包括但不限于以下方面:
a)审计的目的;
b)审计的产品、生产地址、部门、过程范围;
c)审计组组成及成员分工;
d)审计的时间和日程安排;
e)审计前准备具体内容或要求 (包括但不限于) :
审核上一次供应商审核结果;
供应商资质文件记录,包括质量协议;
偏差文件, 投诉文件,变更文件;
年度质量回顾;
监管机构合规记录(例如不良事件报告、警告信);
供应商注册及证明书;
主要设备清单;
4、现场审计实施
a)审计首次会
审计组进入受审计方后, 应按照审计计划的安排举行首次会议。首次会议由审计组长主持, 受审计方相关人员应参加会议。首次会议应明确审计的目的、范围、依据及具体工作要求,制药组织和受审计方均应保持首次会议 的相关记录。
b)审计信息确认:
1)书面审计
在现场质量审计前或现场审计同步进行,一般质量管理部对拟采购药用胶塞的受审计方发出《供应商调查问卷》,由受审计方填写,并同时提供相应的资质材料,《供应商调查问卷》示例如下表:
供应商调查问卷(示例)






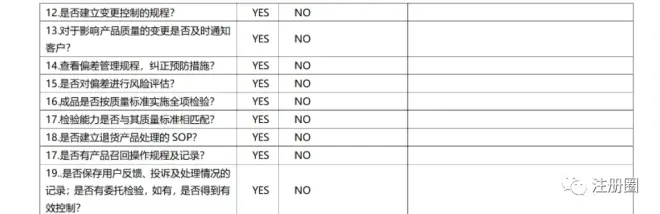

2)资质审计
受审计方应向审计组提供以下资质资料 (包括但不限于) :
——营业执照;
——药包材登记号;
——工艺流程图;
——组织机构图;
——厂区平面布局图;
——质量体系认证证书(包括质量认证机构以外的其它第三方质量审计报告);
——产品的质量标准或产品规范;
——产品的检测报告;
——产品报价、供货保证等其它采购所需的资料。
合格标准为现场确认具有以上资质证明材料且均在有效期内,生产、经营的范围包括拟供货的物料。
3)生产现场审计
审计组应按照此审计指南的内容和要求开展生产现场审计。如为再次审计, 需对上次质量审计不符 合项整改情况进行确认。《现场审计项目表》示例如下表:
现场审计项目表(示例)

c)末次会议
在审计结束时,与供应商管理层召开末次会议,末次会议由审计组长主持,参加会议人员一般与首次会议相同。末次会议上应简述审计情况,通报不符合事实及改进的建议和要求。必要时,对审计中涉及到的商业机密予以承诺。
5、编写供应商质量审计报告
一般情况下,审计报告应在审计完成后两周内发出,审计报告经药企质量管理负责人(有些公司是质量受权人)批准,于 10-20 个工作日内将审计报告发放给受审计方。《供应商审计报告》完成后需要及时归档保存。审计报告应包括以下内容:
—— 审计范围、依据;
—— 审计条件(动态、静态)、审计属性(首次、周期性、临时性)
—— 审计组成员及职务、胶塞生产企业陪同审计人员及职务;
—— 审计过程概述:供应商基本情况、上次审计不符合项整改情况确认、现场检查内容;
——本次审计中发现的缺陷和建议;
—— 审计结论:如果存在严重不符合,则向受审计方说明情况后, 结束审计。
6、供应商改进措施及效果验证
a)审计不符合项发出
药企将审计期间发现的不符合项发给胶塞生产企业,要求的反馈时间应在最终报告发出后两个工作周内,最迟不能超过一个月。
b)供应商CAPA回复
受审计方应针对审计提出的缺陷和建议进行原因分析、制定改进措施并予以实施,审计员有责任对所有的纠正及预防措施,以及实施计划的充分性进行复核。提交的纠正措施应存档,必要时,制药组织对受审计方改进措施实施的效果进行书面或现场验证。改进措施及效果验证的记录应予以保持。
7、确定合格供应商
当所有的CAPA及相关证据可被质量管理部门接受时,审计即可关闭, 质量管理部汇总审计情况,并填写《供应商审批表》 ,报质量管理负责人(有些公司是质量受权人)批准。批准后还需要做以下几项工作:
a)签订质量协议
药企对胶塞 供应商进行资质审核及现场审核后,如符合要求统一购进则需要与胶塞供应商签订质量协议,其主要内 容约定从原材料采购、生产、贮存、运输、接收检验双方所约定的权力与责任, 并且在协议中明确双方 所承担的法律责任。
b)建立档案
档案内容应包括但不限于胶塞供应商的资质证明文件、质量协议、质量标准、 样品检验数据和报告、供应商的检验报告、现场质量审计报告、产品稳定性考察报告、定期的质量回顾 分析报告等。审计资料由质量管理部门归档。
c)确定下次审计日期
药用胶塞一般为关键物料,供应商再审计周期一般为一年。
参考文献
[1] www.cnppa.org
[2] 制药项目管理联盟
声明:文章转载于【注册圈】,作者【滴水司南】,文章版权归原作者所有,本文仅做转载分享~

