始祖病毒类似物——朊病毒
今天介绍的是朊病毒(Prion),它与始祖病毒(Protovirus)一样,非常的古老。


简介
朊病毒是错误折叠的蛋白质,具有将错误折叠的形状传递到同一蛋白质的正常变体上的能力。 它们表征了人类和许多其他动物中几种致命的和可传播的神经退行性疾病。目前尚不清楚是什么原因导致正常蛋白质错误折叠,但是怀疑具有异常的三维结构会赋予传染性,使附近的蛋白质分子塌陷成相同的形状。朊病毒一词源自“蛋白质感染性颗粒”。蛋白质作为传染原的假设作用与所有其他已知的传染原(如病毒、细菌、真菌和寄生虫)相反,它们均无核酸(DNA、RNA或两者)。
朊病毒蛋白(PrP)的同工型蛋白,其具体功能尚不确定,被认为是传染性海绵状脑病(TSE)——包括绵羊的瘙痒病、鹿的慢性消耗性疾病(CWD)、牛海绵状脑病(BSE,通常称为“疯牛病”)和人类克雅氏病(CJD)的罪魁祸首。哺乳动物中所有已知的病毒疾病都会影响大脑或其他神经组织的结构。 所有这些都是进展性的,没有已知有效的治疗方法,并且总是致命的。直到2015年,所有已知的哺乳动物朊病毒病都被认为是由朊病毒蛋白(PrP)引起的;据推测,多系统萎缩(MSA)是由朊病毒形式的α-突触核蛋白引起的。
朊病毒形成称为淀粉样蛋白的蛋白质异常聚集体,这些蛋白质聚集在受感染的组织中,并与组织损伤和细胞死亡有关。淀粉样蛋白还负责其他几种神经退行性疾病,例如阿尔茨海默氏病和帕金森氏病。朊病毒聚集体是稳定的,并且这种结构稳定性意味着朊病毒可以抵抗化学和物理试剂的变性:它们不能通过常规的消毒或烹饪来破坏,这使得这些颗粒的处置和封闭变得困难。
朊病毒病是一种蛋白质病,或结构异常蛋白质引发的疾病。在人类中,朊病毒被认为是引起克雅氏病(CJD)、变异克雅氏病(vCJD)、格斯特曼-斯脱司勒-史茵克综合征(GSS)、致死性家族性失眠症(FFI)和库鲁病的原因。也有证据表明朊病毒可能在阿尔茨海默氏病(Alzheimer's Disease)、帕金森氏病(Parkinson's Disease)和肌萎缩性侧索硬化症(ALS)——朊病毒样疾病的过程中起作用。此外,有几种真菌(酵母)蛋白也被鉴定具有朊病毒作用。与其他形式的复制一样,朊病毒的复制也受到表观突变和自然选择的影响,并且它们的结构在物种之间略有不同。
名字的由来
朊病毒一词,由Stanley B. Prusiner于1982年创造,它源自蛋白质(Protein)和感染性(Infection),因此被称为朊病毒(Prion),是“蛋白质感染性颗粒”的缩写,它传播并将其构象传递给其他蛋白质。
朊病毒的历史
在1950年代,Carleton Gajdusek开始研究,最终表明库鲁可以通过一种可能的新的传染媒介传播给黑猩猩,他的研究最终使他获得了1976年诺贝尔奖。 在1960年代,两名伦敦研究人员,放射生物学家Tikvah Alper和生物物理学家John Stanley Griffith提出了一种假设,即传染性海绵状脑病是由仅由蛋白质组成的传染原引起的。E.J.菲尔德对瘙痒病和库鲁病的调查发现了证据,证明在新宿主中转移了病理惰性的多聚体,这些多聚体仅在转移后才具有传染性。阿尔珀(Alper)和格里菲斯(Griffith)希望解释这一发现,即引起瘙痒病和克雅氏病(Creutzfeldt–Jakob Disease)的神秘传染病抵抗电离辐射。格里菲斯(Griffith)提出了三种方法使蛋白质成为病原体。
在第一个假设,他建议,如果蛋白质通常抑制基因的产物,并引入蛋白可以诱导基因的表达,也就是说,唤醒休眠基因,那么结果将是一个过程的复制,基因的表达会产生蛋白质,然后唤醒其他细胞中的基因。
他的第二个假设构成了现代朊病毒理论的基础,提出细胞蛋白质的异常形态可以将同一类型的正常蛋白质转化为异常形态,从而导致复制。
他提出的第三个假说认为,如果抗体是自身的靶抗原,那么病原可能是抗体,因为这种抗体会产生越来越多的抗体来对抗自身。然而,格里菲斯承认,由于缺乏可检测的免疫反应,第三个假设不太可能是真的。
弗朗西斯·克里克(Francis Crick)在他1970年出版的《分子生物学中心教条》(Central doctrine of molecular biology)第二版中认识到格里菲斯(Griffith)蛋白单假说对痒病传播的潜在意义:在断言序列信息从蛋白质到蛋白质,或者从蛋白质到RNA和DNA的流动被“排除”的同时,他指出格里菲斯的假设是一个潜在的矛盾(尽管格里菲斯并没有这么提倡)。修正后的假说后来被提出,部分原因是为了适应逆转录(Howard Temin和David Baltimore于1970年发现)。
1982年,美国加利福尼亚大学旧金山分校的斯坦利·普鲁西纳(Stanley B. Prusiner)宣布,他的研究小组已经纯化了假设的感染性蛋白质,尽管直到两年后他们才设法分离出这种蛋白质,但它们似乎并未出现在健康宿主中 在普鲁西纳宣布之后。该蛋白质被命名为朊病毒蛋白,意为“蛋白质感染性颗粒”,源于“蛋白质和感染”一词。 当发现朊病毒时,格里菲斯(Griffith)的第一个假设即认为该蛋白质是正常沉默基因的产物,因此受到许多人的青睐。 但随后发现,正常宿主中存在相同的蛋白质,但形式不同。
在未感染的个体中发现相同蛋白质的不同形式后,朊病毒组成的特定蛋白质被称为朊病毒蛋白(PrP),格里菲斯的第二个假设是宿主蛋白质的异常形式可以转化宿主蛋白质的其他蛋白质。 相同类型变成其异常形式,成为主导理论。普鲁西纳因研究朊病毒而获得了1997年诺贝尔生理学或医学奖。
(文中的格里菲斯,是做肺炎链球菌转化实验的弗雷德里克·格里菲斯的侄子。)
物理与化学性质
杜鹃:下面,关于朊病毒的物理化学性质,我以人类的PRNP作为模板。
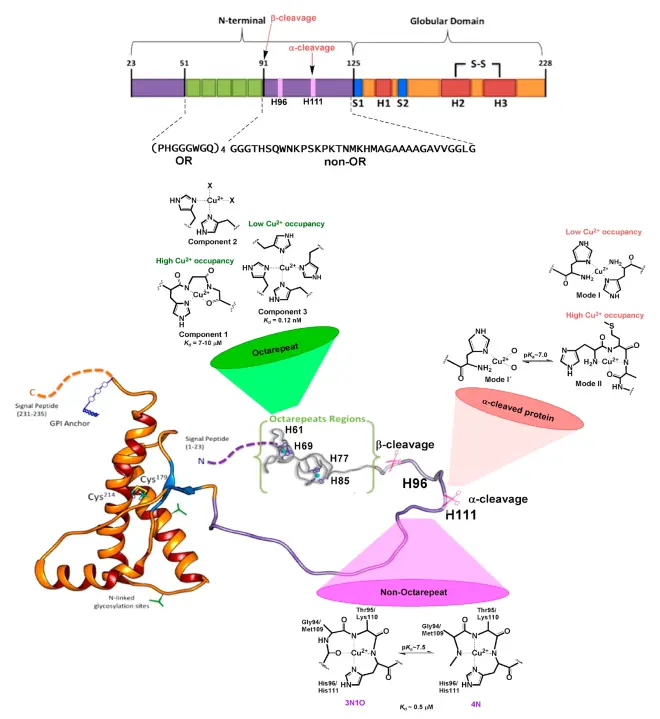
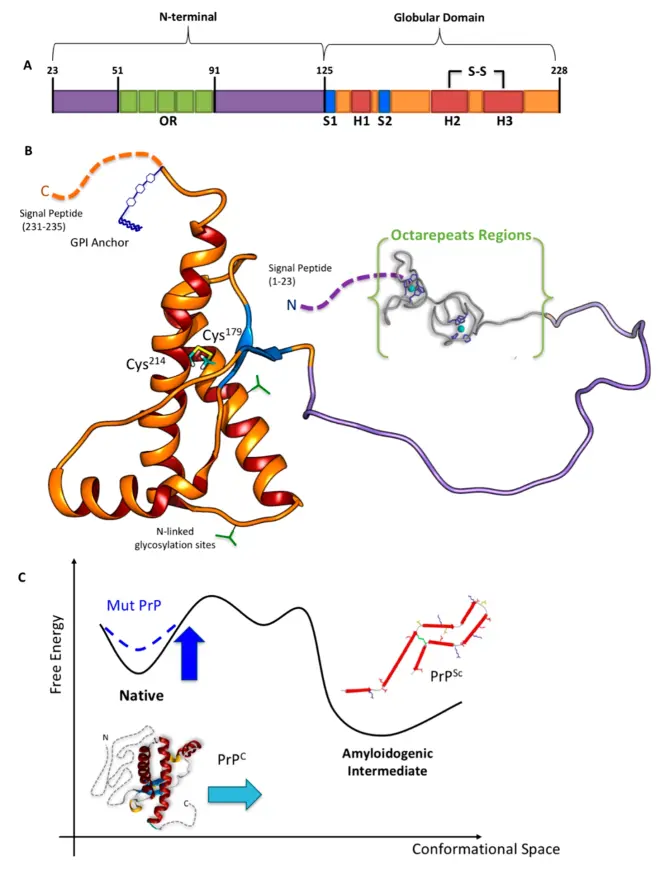
人类的PRNP位于人类20号染色体上,基因的开放阅读框(ORF)为:ATGGCGAACCTTGGCTGCTGGATGCTGGTTCTCTTTGTGGCCACATGGAGTGACCTGGGCCTCTGCAAGAAGCGCCCGAAGCCTGGAGGATGGAACACTGGGGGCAGCCGATACCCGGGGCAGGGCAGCCCTGGAGGCAACCGCTACCCACCTCAGGGCGGTGGTGGCTGGGGGCAGCCTCATGGTGGTGGCTGGGGGCAGCCTCATGGTGGTGGCTGGGGGCAGCCCCATGGTGGTGGCTGGGGACAGCCTCATGGTGGTGGCTGGGGTCAAGGAGGTGGCACCCACAGTCAGTGGAACAAGCCGAGTAAGCCAAAAACCAACATGAAGCACATGGCTGGTGCTGCAGCAGCTGGGGCAGTGGTGGGGGGCCTTGGCGGCTACATGCTGGGAAGTGCCATGAGCAGGCCCATCATACATTTCGGCAGTGACTATGAGGACCGTTACTATCGTGAAAACATGCACCGTTACCCCAACCAAGTGTACTACAGGCCCATGGATGAGTACAGCAACCAGAACAACTTTGTGCACGACTGCGTCAATATCACAATCAAGCAGCACACGGTCACCACAACCACCAAGGGGGAGAACTTCACCGAGACCGACGTTAAGATGATGGAGCGCGTGGTTGAGCAGATGTGTATCACCCAGTACGAGAGGGAATCTCAGGCCTATTACCAGAGAGGATCGAGCATGGTCCTCTTCTCCTCTCCACCTGTGATCCTCCTGATCTCTTTCCTCATCTTCCTGATAGTGGGATGA。
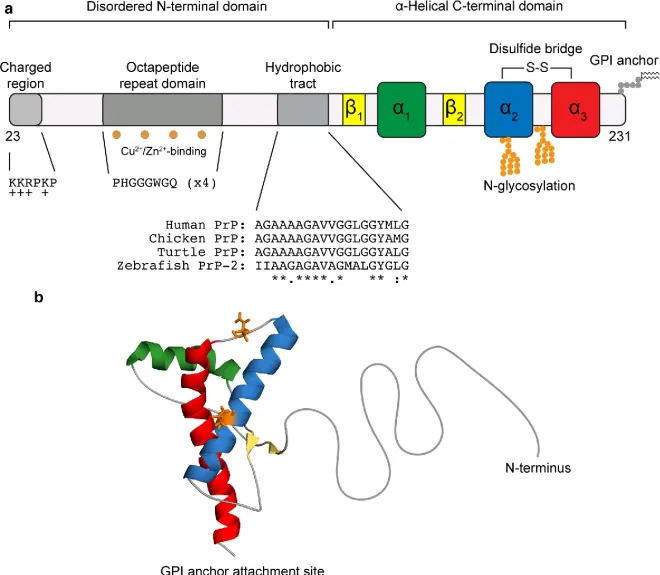
这是人类的PRNP氨基酸序列:MANLGCWMLVLFVATWSDLGLCKKRPKPGGWNTGGSRYPGQGSPGGNRYPPQGGGGWGQPHGGGWGQPHGGGWGQPHGGGWGQPHGGGWGQGGGTHSQWNKPSKPKTNMKHMAGAAAAGAVVGGLGGYMLGSAMSRPIIHFGSDYEDRYYRENMHRYPNQVYYRPMDEYSNQNNFVHDCVNITIKQHTVTTTTKGENFTETDVKMMERVVEQMCITQYERESQAYYQRGSSMVLFSSPPVILLISFLIFLIVG。PRNP蛋白为由253个氨基酸组成的丝状多肽,是朊病毒的前体,尾部多肽SMVLFSSPPVILLISFLIFLIVG被剪切后成熟,成为由230个氨基酸组成的朊病毒。
蛋白质结构
朊病毒这种蛋白质(PrP)遍布全身,即使在健康的人和动物中也是如此。 但是,在传染性材料中发现的PrP具有不同的结构,并且对蛋白酶具有抵抗力,而蛋白酶是体内通常可以分解蛋白质的酶。 该蛋白质的正常形式称为PrPC,而传染形式称为PrPSc——C表示“细胞性” PrP,而Sc表示在绵羊中发生的原型朊病毒疾病“瘙痒症/scrapie”。虽然PrPC在结构上定义明确,但PrPSc肯定是多分散的,并且定义相对较差。 可以在体外诱导PrP折叠成其他或多或少明确的同工型,并且它们与体内致病性形式之间的关系尚不清楚。
PrPC
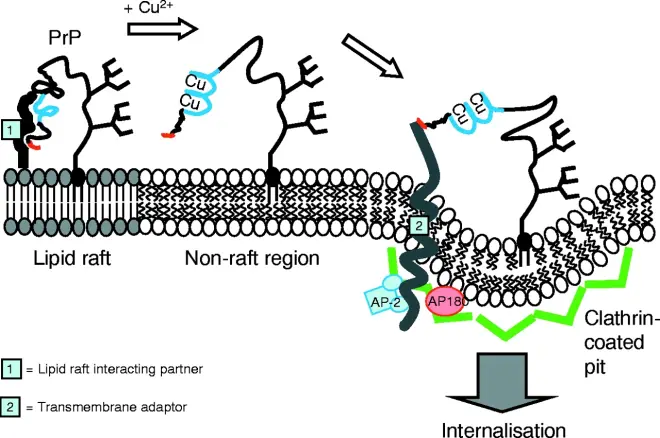
PrPC是在细胞膜上发现的正常蛋白质。 它具有209个氨基酸(人类,已加工),一个二硫键,35-36kDa的分子量和主要的α螺旋结构。 存在几种拓扑形式。 一种通过糖脂固定的细胞表面形式和两种跨膜形式。正常蛋白质不能沉淀; 表示无法通过离心技术将其分离。它的功能是一个复杂的问题,将继续进行调查。 PrPC以高亲和力结合铜离子(Cu2+)。该发现的意义尚不清楚,但推测与PrP的结构或功能有关。 PrPC容易被蛋白酶K消化,并可以在体外通过磷酸肌醇磷脂酶C(PI-PLC)从细胞表面释放出来,该酶裂解糖磷脂酰肌醇(GPI)糖脂锚。据报道,PrP在体内细胞-细胞粘附和细胞内信号传导中起重要作用,因此可能参与大脑中的细胞—细胞信息交换。
PrPres
耐蛋白酶的PrPSc样蛋白(PrPres)是PrPc的任何同工型的名称,该同工酶在体外结构发生改变并转化为错折叠的耐K蛋白酶形式。为了在体外模拟PrPC到PrPSc的转化,Saborio等人。 通过涉及蛋白质错误折叠的循环扩增的程序,迅速将PrPC转化为PrPres。“PrPres”一词已用于区分PrPSc,PrPSc是从传染性组织中分离出来的,并且与可传播的海绵状脑病病原有关。但是,与PrPSc不同,PrPres不一定具有传染性。
PrPSc
PrP的传染性同工型,称为PrPSc,或简称为朊病毒,能够通过改变其构象或形状将正常的PrPC蛋白转化为传染性同工型。 反过来,这改变了蛋白质相互连接的方式。PrPSc总是引起病毒疾病。 尽管不知道PrPSc的确切3D结构,但是它具有更高比例的β-折叠结构代替正常的α-螺旋结构。这些异常同工型的聚集体形成高度结构化的淀粉样蛋白纤维,其积聚形成斑块。 每根纤维的末端充当模板,游离蛋白分子可以附着在该模板上,从而使纤维得以生长。 在大多数情况下,只有具有与感染性PrPSc氨基酸序列相同的PrP分子才能被掺入到生长的纤维中。然而,罕见的跨物种传播也是可能的。
朊病毒的正常功能
朊病毒蛋白的生理功能仍然知之甚少。 尽管来自体外实验的数据显示出许多不同的作用,但对PrP基因敲除小鼠的研究仅提供了有限的信息,因为这些动物仅表现出较小的异常。 在对小鼠的研究中,发现周围神经中PrP蛋白的切割会导致Schwann细胞中髓磷脂修复的激活,而PrP蛋白的缺乏会导致这些细胞中的脱髓鞘。
PrP和调节细胞死亡
MAVS,RIP1和RIP3是在人体其他部位发现的病毒样蛋白。 它们还聚合成丝状淀粉样蛋白纤维,在病毒感染的情况下,这种蛋白可启动受调控的细胞死亡,以防止病毒体扩散到周围的其他细胞。
PrP和长期记忆
2005年的证据回顾表明,PrP在维持长期记忆方面可能具有正常功能。同样,2004年的一项研究发现,缺乏正常细胞PrP蛋白基因的小鼠表现出改变的海马长时程增强。 最近的一项研究可能解释了为什么发现神经元蛋白CPEB具有与酵母病毒蛋白相似的遗传序列的原因。CPEB的病毒样形成对于维持与长期记忆形成有关的长期突触变化至关重要。
PrP和干细胞更新
Whitehead生物医学研究所在2006年发表的一篇文章指出,PrP在干细胞上的表达对于生物体的骨髓自我更新是必需的。 研究表明,所有长期造血干细胞都在其细胞膜上表达PrP,而具有PrP-null干细胞的造血组织对细胞耗竭的敏感性更高。
PrP和先天免疫
有证据表明,PrP可能在先天免疫中起作用,因为在许多病毒感染中,PrP基因PRNP的表达上调,并且PrP对包括HIV在内的许多病毒具有抗病毒特性。
朊病毒复制

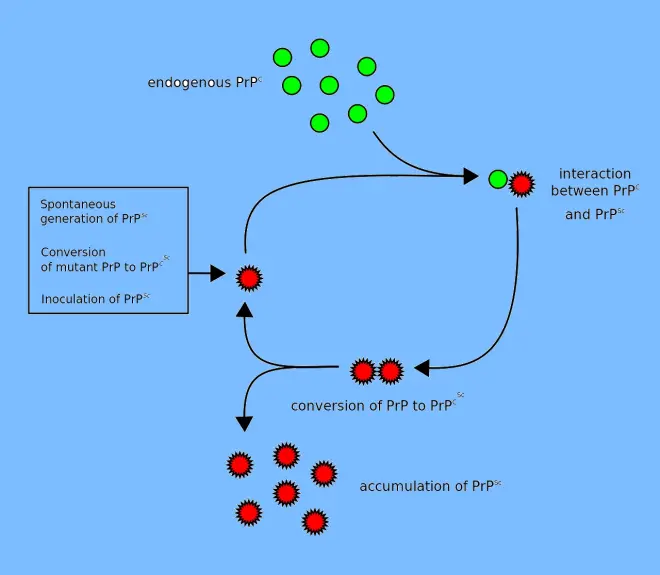
试图解释病毒仅以蛋白质方式复制的第一个假设是异二聚体模型。该模型假定单个PrPSc分子与单个PrPC分子结合并催化其转化为PrPSc。 然后,两个PrPSc分子分开并可以继续转化更多的PrPC。 但是,朊病毒复制模型必须说明病毒如何传播以及为何其自发出现如此罕见。 曼弗雷德·艾根(Manfred Eigen)表明,异二聚体模型要求PrPSc是非常有效的催化剂,将转化反应速率提高了约10^15倍。如果PrPSc仅以聚集形式(如淀粉样蛋白)存在,则不会出现此问题,其中合作性可能会成为自发转化的障碍。 而且,尽管付出了巨大的努力,但传染性单体PrPSc从未被分离出来。
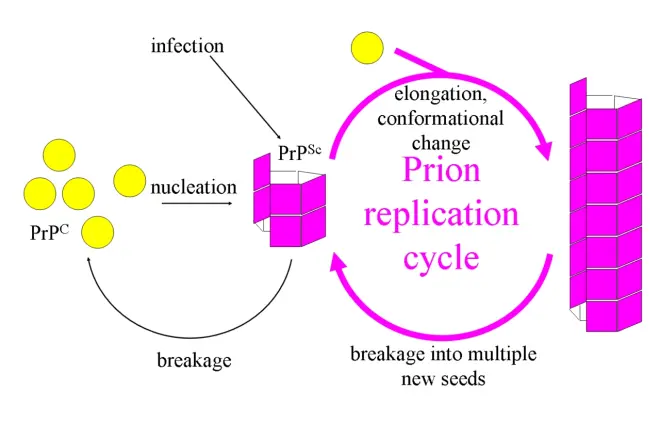
另一种模型假定PrPSc仅以原纤维形式存在,并且原纤维末端结合PrPC并将其转化为PrPSc。 如果全部如此,则病毒的数量将线性增加,从而形成更长的原纤维。 但是在病毒病期间,PrPSc和感染颗粒的数量均呈指数增长。这可以通过考虑原纤维断裂来解释。已经找到了由原纤维生长和原纤维断裂相结合而导致的指数增长率的数学解。指数增长率主要取决于PrPC浓度的平方根。潜伏期由指数增长率决定,转基因小鼠中朊病毒疾病的体内数据与该预测相符。在各种不同的淀粉样蛋白实验中,在体外也发现了相同的平方根依赖性。
朊病毒复制的机制对设计药物有影响。由于朊病毒疾病的潜伏期很长,因此一种有效的药物并不需要消除所有朊病毒,而只需要减慢指数增长的速度即可。模型预测表明,使用可能的最低剂量的药物来实现此目的的最有效方法是找到一种与原纤维末端结合并阻止其进一步生长的药物。
达特茅斯学院的研究人员发现,内源性宿主辅因子分子:例如磷脂分子(磷脂酰乙醇胺)和聚阴离子与单链RNA分子对于在体外形成具有高水平特异性感染力的PrPSc分子是必不可少的,而仅有蛋白质的PrPSc分子会出现缺乏显着水平的生物感染性。
朊病毒病


朊病毒通过在中枢神经系统内在细胞外聚集形成称为淀粉样蛋白的斑块而引起神经退行性疾病,从而破坏正常组织结构。 这种破坏的特征是由于神经元中的液泡形成,导致组织中的“孔”形成海绵状结构。其他组织学变化包括星形胶质细胞增多症和无炎症反应。病毒疾病的潜伏期相对较长(5至20年),一旦出现症状,疾病就会迅速发展,导致脑损伤甚至死亡。神经退行性症状可包括惊厥、痴呆、共济失调(平衡和协调功能障碍)以及行为或人格改变。
朊病毒疾病可能会影响许多不同的哺乳动物物种,因为朊病毒蛋白质(PrP)在所有哺乳动物中都非常相似。由于不同物种之间PrP的细微差异,朊病毒疾病从一种物种传播到另一种物种并不常见。 然而,人类朊病毒病,变种克雅氏病被认为是由通常感染牛,引起牛海绵状脑病并通过受感染的肉传播的朊病毒引起的。
所有已知的病毒疾病都是无法治愈且致命的。然而,在小鼠体内开发的疫苗可能会为提供一种抵抗人类病毒感染的疫苗提供见识。此外,2006年科学家宣布,他们对缺少朊病毒生产必需基因的牛进行了基因工程改造,因此从理论上讲使它们对BSE免疫。在研究表明缺乏正常病毒蛋白的小鼠具有抗瘙痒朊病毒蛋白感染的能力的基础上,2013年的一项研究表明,英国每2000人中就有1人可能携带导致vCJD的感染性病毒蛋白。
直到2015年,所有已知的哺乳动物病毒疾病都被认为是由朊病毒PrP引起的; 在2015年,发现多系统萎缩是可以传播的,并被认为是由新的病毒引起的,,病毒是一种错误折叠的蛋白质,称为α-突触核蛋白。在一种疾病首先与病毒和神经变性有关之后,朊病毒蛋白的内源性,正确折叠的形式称为PrPC,而与疾病相关的,错误折叠的形式称为PrPSc。朊病毒的确切结构尚不清楚,尽管它们可以在蛋白质错误折叠循环扩增(PMCA)反应中通过结合PrPC,均聚聚腺苷酸和脂质而自发形成,即使在没有预先存在的感染性病毒的情况下也是如此。该结果进一步证明了病毒复制不需要遗传信息。
传染方式
人们已经认识到病毒疾病可以通过三种不同的方式出现:后天性、家族性或散发性疾病。通常认为,患病形式与正常形式直接相互作用以使其重新排列其结构。 一个想法,即“蛋白质X”假说,是迄今尚未鉴定的细胞蛋白(蛋白质X)通过将两者的分子结合成复合物而使PrPC转化为PrPSc。
动物感染的主要方法是通过食入。 人们认为病毒可能会通过死动物的遗体以及尿液,唾液和其他体液沉积在环境中。 然后它们会通过与粘土和其他矿物质的结合而留在土壤中。
加利福尼亚大学的一个研究小组已为该理论提供了证据,证明粪便中的朊病毒可引起感染。并且,由于肥料存在于水库周围的许多区域,并且用于许多农田,因此增加了广泛传播的可能性。 据报道,2011年1月,在一项针对实验室小鼠瘙痒病感染的动物实验中,研究人员发现了通过空气传播传播的病毒在气溶胶颗粒上的扩散。2011年发表了初步证据,证明朊病毒可以通过使用尿液中的人类更年期促性腺激素来传播,该药物被用于治疗不育症。
朊病毒相关疾病
科学家已在多种其他哺乳动物蛋白中发现了病毒样结构域。 这些蛋白质中的一些已与年龄相关的神经退行性疾病的个体发生有关,例如肌萎缩性侧索硬化症(ALS)、额颞叶大叶变性及泛素阳性包涵体(FTLD-U)、阿尔茨海默氏病、帕金森氏病和亨廷顿氏病。它们还涉及某些形式的系统性淀粉样变性病,包括在患有炎症和传染性疾病(例如结核病、克罗恩病、类风湿性关节炎和AIDS)的人和动物中发展的AA淀粉样变性。像朊病毒一样,AA淀粉样变性病可以传播。这就产生了“朊病毒范式”——无害的蛋白质可以通过少量错误折叠形成的有害蛋白质而转化为致病性形式。
真菌朊病毒样结构域的定义来自真菌朊病毒的研究。在酵母中,朊病毒蛋白具有一个可携带的病毒结构域,对于自模板化和蛋白质聚集而言既是必需的又是足够的。 这是通过将朊病毒结构域连接到报告蛋白上而显示的,然后该报告蛋白像已知的病毒一样聚集。 类似地,从真菌病毒蛋白中去除朊病毒域可以抑制病毒的产生。 对朊病毒行为的这种模块化观点导致了这样一个假说,即除了PrP以外,动物蛋白中也存在类似的病毒域。这些真菌朊病毒结构域具有几个特征序列特征。 它们通常富含天冬酰胺,谷氨酰胺,酪氨酸和甘氨酸残基,其中天冬酰胺的偏倚特别有利于朊病毒的聚集性质。从历史上看,病毒的形成与序列无关,仅取决于相对残基含量。 然而,事实证明这是错误的,脯氨酸和带电残基的间距已被证明对淀粉样蛋白的形成至关重要。
生物信息学筛选已经预测,超过250种人类蛋白质包含朊病毒样结构域(PrLD)。 假定这些结构域具有与PrP和已知真菌蛋白相同的可传播淀粉样蛋白特性。与酵母中的真菌朊病毒一样,与其他类型的蛋白质相比,参与基因表达和RNA结合的蛋白质似乎在PrLD中特别丰富。 特别地,已知的具有RNA识别基序的210种蛋白质中的29种也具有推定的pr病毒结构域。 同时,这些RNA结合蛋白中的几种已被独立鉴定为ALS、FTLD-U、阿尔茨海默氏病和亨廷顿氏病的罪魁祸首。
神经退行性疾病
朊病毒和具有朊病毒样结构域的蛋白质的致病性被认为是由于它们的自模板能力和淀粉样蛋白原纤维的指数增长所致。 变性疾病患者中淀粉样蛋白原纤维的存在已被充分证明。 这些淀粉样蛋白原纤维被认为是致病蛋白质的结果,这些蛋白质能够自我传播并形成高度稳定的非功能性聚集体。虽然这不一定意味着淀粉样蛋白与变性疾病之间存在因果关系,但某些淀粉样蛋白形式的毒性以及在变性疾病的家族性病例中淀粉样蛋白的过度生产支持淀粉样蛋白形成通常具有毒性的观点。
具体而言,已经在ALS/MND患者中发现了RNA结合蛋白TDP-43的聚集,并且在ALS/MND家族病例中已经鉴定出编码这些蛋白的基因中的突变。 这些突变促进蛋白质错误折叠成a病毒样构象。TDP-43的错误折叠形式在受累神经元中形成细胞质内含物,并在细胞核中被耗尽。 除ALS/MND和FTLD-U外,TDP-43病理是许多阿尔茨海默氏病,帕金森氏病和亨廷顿氏病的特征。TDP-43的错误折叠主要是由其病毒样结构域引起的。该结构域固有地容易发生错误折叠,而已发现TDP-43中的病理突变会增加这种错误折叠的可能性,这说明了在ALS/MND家族病例中这些突变的存在。与酵母一样,已证明TDP-43的病毒样结构域对于蛋白质错误折叠和聚集既必要又充分。
同样,在家族性肌肉、脑、骨骼和运动神经元变性病例中,已在异质核糖蛋白hnRNPA2B1和hnRNPA1的病毒样结构域中鉴定出致病性突变。 所有这些蛋白质的野生型形式都表现出自组装成淀粉样蛋白原纤维的趋势,而致病性突变则加剧了这种行为并导致过多的积累。
自然降解抵抗
压倒性的证据表明病毒能抗降解并在环境中存在多年,而蛋白酶不会降解它们。实验证据表明,未结合的朊病毒会随时间而降解,而与土壤结合的朊病毒则保持稳定或增加水平,这表明朊病毒可能会在环境中积累。
植物朊病毒
2015年,位于休斯敦的德克萨斯大学健康科学中心的研究人员发现,植物可以成为朊病毒的载体。 当研究人员给仓鼠喂食生长在埋有死于慢性消耗性疾病(CWD)的鹿的地面上的草时,仓鼠患了CWD,这表明朊病毒可以与植物结合,然后将其吸收到叶和茎结构中,它们可以被草食动物食用,从而完成了整个周期。 因此有可能在环境中逐渐积累朊病毒。
不光光是动物、植物与真菌,连细菌与病毒(杆状病毒Lef-10),都逃不过朊病毒的魔爪。
朊病毒的灭活
具有核酸的感染性颗粒依赖于核酸来指导其继续复制。 然而,朊病毒对蛋白质的正常形式具有感染力。 因此,对朊病毒进行消毒需要将蛋白质变性至分子不再能够诱导正常蛋白质异常折叠的状态。虽然,朊病毒对蛋白酶,热,电离辐射和甲醛处理具有相当的抵抗力,但是,通过这种处理可以降低它们的传染性。
有效的消毒剂,包括次氯酸钠、氢氧化钠和强酸性清洁剂,依赖于蛋白质水解或蛋白质三级结构的还原或破坏。已发现在加压蒸汽高压釜中在134°C(273°F)的温度下放置18分钟对灭活朊病毒有些有效。目前正在研究将臭氧灭菌作为朊病毒变性和失活的一种潜在方法。朊病毒尚未将完全变性的朊病毒复性为感染状态。 但是,在某些人工条件下,可以将部分变性的朊病毒还原为感染状态。
世界卫生组织建议对所有耐热外科手术器械进行以下三种消毒程序中的任何一种,以确保它们不被朊病毒污染:
1.浸入1N氢氧化钠中,并在121°C的重力置换高压釜中放置30分钟;用水冲洗;洁净,然后执行常规灭菌过程。
2.浸入1N次氯酸钠(有效氯含量20000ppm)中1小时; 将仪器转移到水中;在重力置换式高压釜中于121°C加热1小时;洁净,然后执行常规灭菌过程。
3.浸入1N氢氧化钠或次氯酸钠(有效氯含量百万分之二万)中1小时; 移出并在水中冲洗,然后转移到敞开的锅中,并在重力位移(121°C)或多孔载体(134°C)高压釜中加热1小时;洁净,然后执行常规灭菌过程。
由此可见,朊病毒很可怕。因此,不要与朊病毒做接触!也不要食用感染朊病毒的动物制品!研究朊病毒,需要生物安全等级3级(BSL-3)实验室!

