【种花家务·化学】1-2-12氢气的性质和用途——『数理化自学丛书66版』
【阅前提示】本书由于是大半个世纪前的教材,很多概念已经与如今迥异,因此不建议零基础学生阅读。但很适合像我这样已接受过基础教育但很不扎实的学酥重新查漏补缺。 另外,黑字是教材原文,彩字是我写的备注。
第二章、氧和氢
§2-12氢气的性质和用途
氢气的性质
1、氢气的物理性质
氢气和氧气一样,在通常状况下,是无色、无味、无嗅的气体。氢气很轻,在所有的气体中,氢气的比重最小,在0℃和1大气压下,每升氢气重0.0899克。这就是说,氢气的重量只及同体积空气(每升空气重1.293克)重量的约1/14.4,“氢气”这个名称就是由于它的这一性质而来的。
在加大压强和降低温度的条件下,氢气也可以变成无色的液体,液态氢在非常低的温度(-253℃)下沸腾。
氢气比氧气更难溶解于水,在20℃和1大气压下,1升水只能溶解18毫升的氢气。
2、氢气的化学性质
在平常温度下,氢气的化学性质是不活泼的,但加热后,它能和某些金属(例如钠、钙等)、非金属(例如硫、氧、氮等)发生化合反应。
下面我们着重来研究氢气和氧的化学反应
(1)氢气和氧气的化合反应
纯净的氢气能够在纯氧或空气里燃烧,发出淡蓝色的火焰。如果把燃烧着氢气的导管,放进玻璃简内(如图2-16所示),不久,就可看到在筒壁上附有极细的水滴。氢气在点燃条件下和氧气化合反应的化学方程式是:【山注,B站专栏公式代码\ce{2H2 + O2}\mathop{=\!=}\limits^{点燃}\ce{2H2O}】因为氢气燃烧时放出大量的热,反应生成的水是以水蒸气状态存在的,水蒸气冷却后凝聚在玻璃筒壁上,形成细微的水滴。
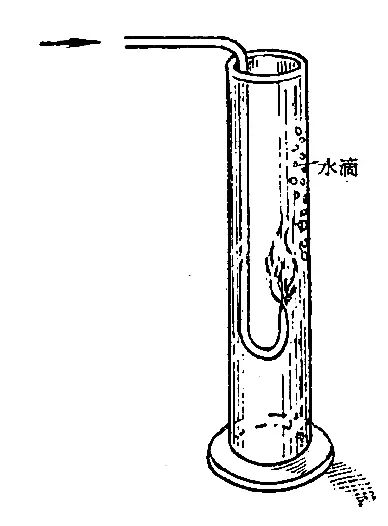
应该注意,在任何时候点燃氢气,都必须先确知它是纯净的。因为如果氢气里混有空气(或氧气),点燃时有可能发生猛烈的爆炸,造成伤害事故。
点燃混有空气(或氧气)的氢气会发生爆炸,这可以通过下面的实验来证明。
先在试管里收集2体积氢气和1体积氧气,使之充分混和,这时试管里的氢气和氧气并不发生反应(因为氢气只有在点燃的条件下才能和氧气发生化合反应),用一根燃着的木条去点燃这一混和气体,立刻发出一种尖锐的爆鸣声。
通常把2体积氢气和1体积氧气的混和气体称做“爆鸣气”。
为什么纯净的氢气能够在纯氧(或空气)里安静地燃烧,而点燃氢气和氧气(或空气)的混和气体时却会发生爆鸣呢?这是因为在导管口点燃纯净的氢气时,只有导管口的氢气和周围的氧气接触,燃烧只在导管口进行,因此不会有任何危险发生,但在混和气体里,全部氢气都和氧气密切接触着,点燃时,一瞬间容器里大量氢气和氧气同时迅速化合,生成水蒸气并放出大量的热。这些水蒸气在极短时间内受热急剧膨胀,如果容器是密闭的,或容器的口很小,这急剧膨胀的气体不能迅速排出,这时容器里的压强就会骤然增大起来,引起猛烈的爆炸。
因此,在制取氢气的装置(例如启普发生器)的导管口点燃氢气前,每次都必须进行检纯(即检验氢气纯度)的手续。只有在确切知道容器里的氢气是纯净时,才能用火接近它。
那末,怎样检纯氢气呢?
先把从制取氢气的装置(例如启普发生器)里放出的氢气,用排水集气法收集在试管里,然后迅速地使试管口(保持向下方向)移近酒精灯火焰,如果发生尖锐的吹口哨似的爆鸣声,这说明氢气里还混有空气,应该重复这种试验,一直到把试管移近火焰时,只听到很轻的声音时,放出的氢气才是纯净的
(2)氢气和某些金属氧化物的反应,还原反应
氢气不但能和游离态的氧化合,在高温下,它还能夺取有些金属氧化物里化合态的氧。这是氢气的另一个重要的化学性质。
现在用下面的实验来说明这一性质。

用一根较粗的硬质玻管,挟住在铁架台上,在玻管a处放进少许黑色的氧化铜粉末.玻管左端用一个带有导管的软木塞塞住,导管和氢气发生器相连(装置见图217).为了安全起见,在加热玻管前,先自导管通入氢气,俟玻管中原有的空气全部被赶走后,再用酒精灯在a处灼热玻管里的氧化铜粉末.这时氢气在热的氧化铜表面通过,不久,表面上一部分氧化铜变成赭色的金属铜.同时,在右端干燥管的b处,可以看到有水滴凝成.这一反应的化学方程式是:
【山注,B站专栏公式代码\ce{CuO + H2}\mathop{=\!=}\limits^{加热}\ce{Cu +H2O}】
在这个反应里,单质氢气分子里的氢原子代替了氧化铜分子里铜原子的位置,和氧原子结合成为水分子,铜原子被置换出来后,变成单质的铜。很显然,这个反应是属于置换反应类型的。
还原反应
上述化学反应里的氧化铜,可以认作是由铜和氧气化合而生成的。现在,氢气夺取了氧化铜里的氧,使它重新变成单质的铜。象这样,氧从一种物质里被夺取出来的反应,叫做还原反应。
从别种物质里夺取氧的物质,叫做还原剂。氢气是最重要的还原剂之一。
在冶金工业上,常利用还原反应来冶炼金属,例如我们在小学自然课里已经学过,用焦炭(它的主要成分是碳元素)可以炼铁,就是把铁矿砂[一般是铁的氧化物,例如磁铁矿的主要成分是四氧化三铁()]里的氧夺取出来,还原成单质的铁。这个反应可以用下面的化学方程式来表示:
【山注,B站专栏公式代码\ce{Fe3O4 +4C}\mathop{=\!=}\limits^{高温}\ce{3Fe +4CO↑}】 碳是工业上最常用的一种重要的还原剂。
氢气的主要用途
氢气的用途也是和它的性质相联系的。
氢气燃烧时能放出大量的热,所以利用氢氧吹管(使氢气在充足的氧气里燃烧的一种装置,结构和氧炔吹管相似),可以得到温度很高(可达到30000C)的氢氧焰,它可以代替氧炔焰,用来焊接或切剖金属制品。
氢气还是重要的化学原料,大量的氢气在工业上用来制造氨()、盐酸(
)等重要化工产品。
习题2-12
1、列表比较氢气和氧气的物理性质,它们有哪些是共同的,哪些是不同的?
2、在启普发生器的导管口点燃氢气时,如果其中混有空气,会发生什么现象?为什么?
【山答】会发生爆鸣,这是因为氢气与混杂其中的氧气密切接触,一旦点燃急速化合,短时间生成较多的水蒸气,再热胀之下,就发生爆鸣。
3、怎样检验氢气的纯度?
【山答】收集一试管产生的气体,管口移近灯焰,如果发出爆鸣声,说明不纯,如果声音很轻,则说明氢气是纯净的。
4、写出氢气在氧气里燃烧的化学方程式。使2克氢气完全燃烧,需要多少克氧气?又能生成水多少克?
【山答】①16g。②18g。
【山注,B站专栏公式代码\color{blue}{\ce{2H2 + O2}\mathop{=\!=}\limits^{点燃}\ce{2H2O}}】
5、多少克氢气和多少克氧化铜完全作用后可以产生32克单质的铜?
【山答】1g;40g。
6、含有杂质的氧化铜50克,用氢气和它发生反应后,得到36克铜。计算含氧化铜的百分率是多少?[提示:先算出生成36克铜所需要的纯氧化铜的克数,再把这个克数和含杂质的氧化铜的克数(50克)相比,就可以知道纯氧化铜的百分率。]
【山答】90%。

