化药常用注册申报流程整理
前言
梳理出常用化学药品注册申报流程和申报资料要求,包括化学药品3类、4类上市许可申请、一致性评价申请、境内外化学原料药登记备案,供大家参考。
一、化学药品3类、4类上市许可注册申报流程
1.1网址:
https://zwfw.nmpa.gov.cn/web/index

1.2 登录:
右上角“登录”-点击“法人登录”进入登录界面
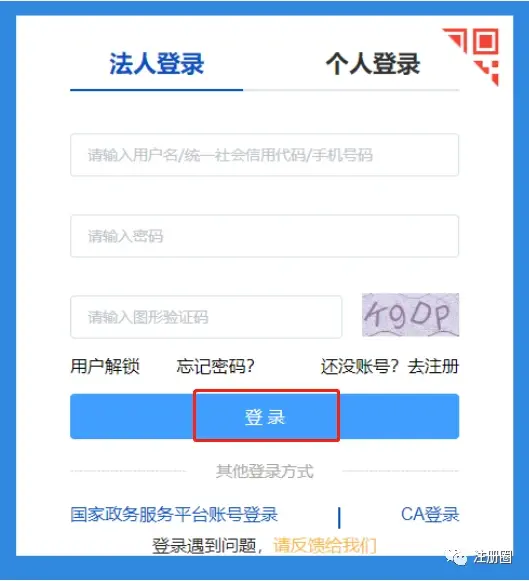
1.3 办事流程
1)点击“账号设置”-“账号绑定”-进入“药品业务应用系统”
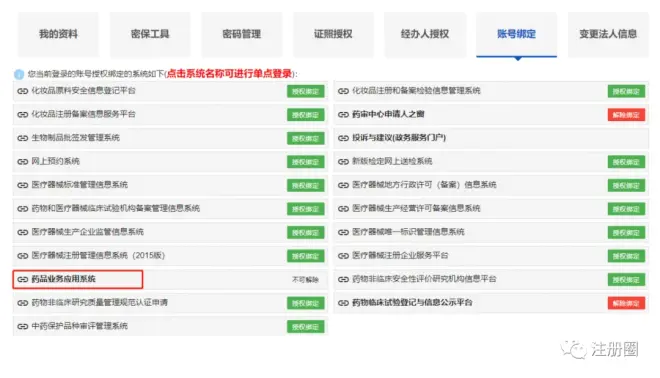
“普通用户登录”

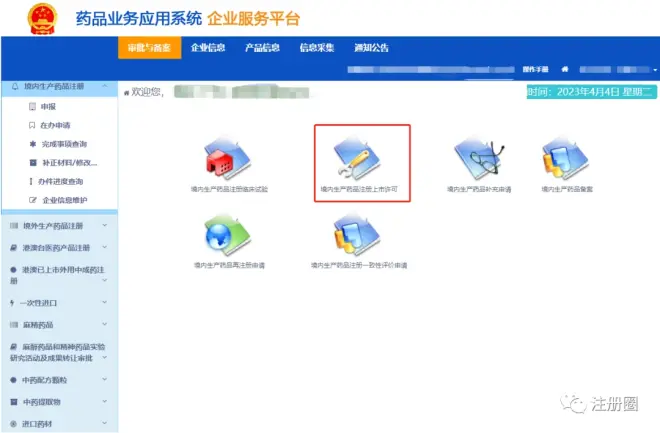
2)选择“境内生产药品注册”

进入后选择“境内生产药品注册上市许可”
3)出现以下界面,填写申请表


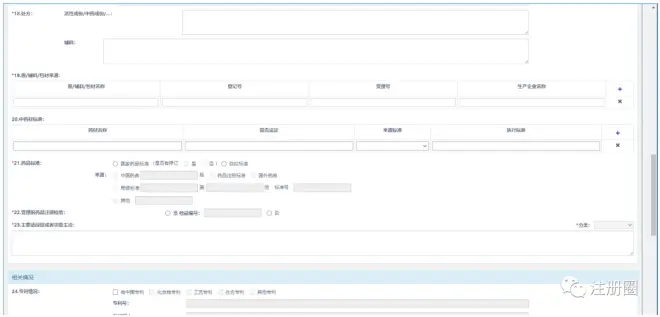

▲ 图1-化药3、4类上市许可申请表-1
点击“暂存”按钮,后进行第二页内容的填写,如下:
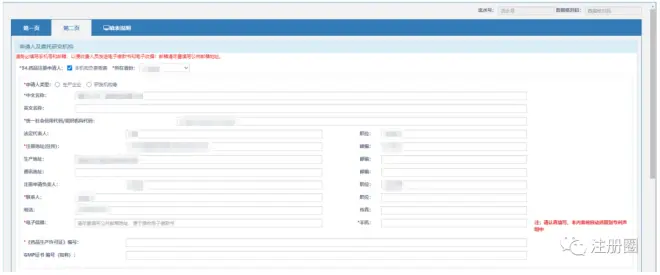

▲ 图2-化药3、4类上市许可申请表-2
全部填写完成后,点击“暂存”保存。
4)暂存后会出现自查表和专利声明,分别填写。

自查表上方的基本信息会自动抓取前面申请表中填写的内容,务必确保信息正确。

自查表2.1项下:第()袋为模块1/2/3/4/5,这是之前纸质资料申报的要求,现在实行电子申报已不适用,根据CDE发布的常见一般性技术问题解答,填不适用即可。


专利声明的基本信息同样系统自动抓取填写,需要手动填写的是中国上市药品专利信息登记平台 (cde.org.cn)中申报品种涉及的专利信息。

这里需要上传已盖章签字的专利情况声明表(上传后建议预览自查一下)。
5)全部信息填写完成、上传附件后,点“暂存”保存,确认不再修改点“申报”正式提交。
二、一致性评价申报流程
2.1 网址:
https://zwfw.nmpa.gov.cn/web/index

2.2登录:
右上角“登录”-点击“法人登录”进入登录界面
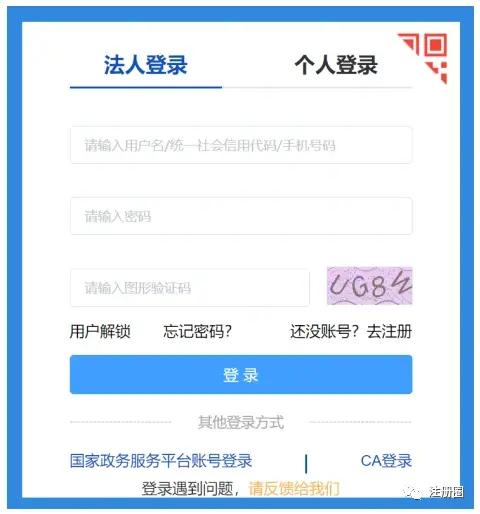
2.3 办事流程
1)点击“账号设置”-“账号绑定”-进入“药品业务应用系统”

“普通用户登录”

2)选择“境内生产药品注册”

选择“境内生产药品注册一致性评价申请”

3)弹出以下窗口,填写所申请产品的批准文号

4)填写申请表




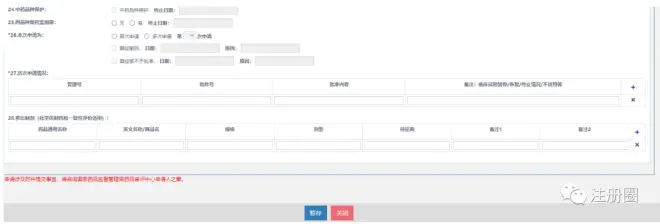
▲ 图3-一致性评价申请表-1
暂存,点第二页


▲ 图4-一致性评价申请表-2
(5)填写完成后点击“暂存”,确认后申报。

一致性评价系统无自查表和专利声明,需另外填写递交。自查表模板如下:▲ 表1-一致性评价自查表




三、境内外化学原料药上市许可注册申报流程
3.1 网址和登录:
原料药登记在CDE申请人之窗填写登记表,可以从NMPA网上办事大厅进入,或从CDE首页进入:
3.1.1 从NMPA网上办事大厅进入网址:https://zwfw.nmpa.gov.cn/web/index

登录:右上角“登录”-点击“法人登录”进入登录界面

点击“账号设置”-“账号绑定”-进入“药审中心申请人之窗”
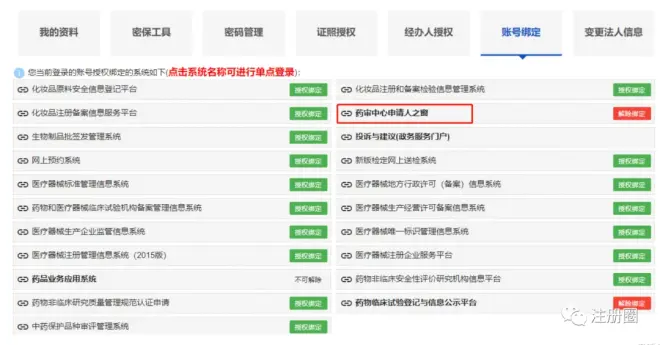
“普通用户登录”

3.1.2 从CDE首页进入网址:https://www.cde.org.cn/

输入登录用户名、密码、手机验证码,登录;或电脑插入Ukey登录。

3.2 办事流程
1)选择“原辅包”-“原料药登记”-“登记中”-“新建”
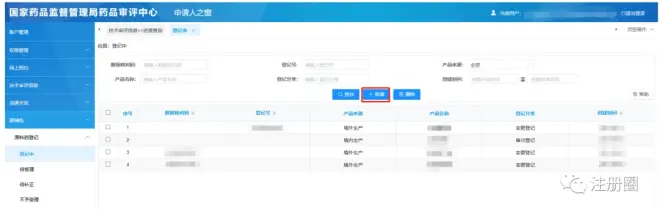
2)根据实际情况选择“境内生产”or“境外生产”等

3)填写登记表
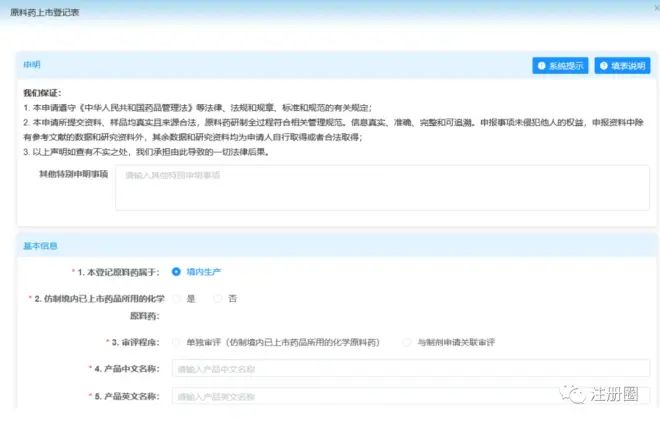




▲ 图5-原料药登记表
全部填写完保存,确认信息不修改后正式提交。
四、申报资料要求和电子申报
4.1 申报资料格式
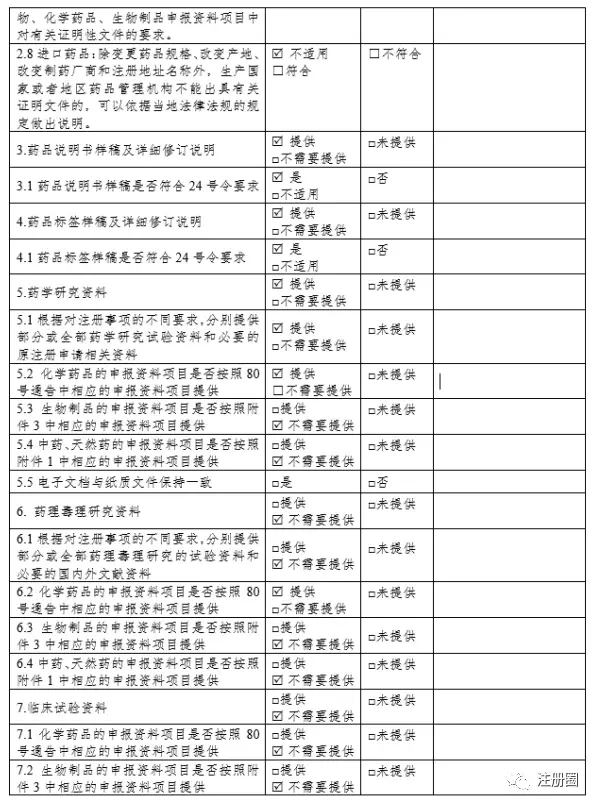
4.1.1 化学药品3、4类申报资料格式
化药3、4类申请上市许可的资料按照M4 CTD格式整理,如下表:▲ 表2-化学药品3、4类申报资料目录

4.1.2一致性评价申报资料格式
(1)注射剂:一致性评价申报资料参照2020年5月14日CDE发布的第2号通告:《化学药品注射剂仿制药质量和疗效一致性评价技术要求》和《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》进行编写,如下表:
▲ 表3-注射剂一致性评价申报资料目录

(一)概要第1—5项及6.2项资料参照《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》(2016年第120号)相关要求整理。第7项资料参照《化学药品新注册分类申报资料要求(试行)》(2016年第80号)及相关要求整理。
(二)药学研究资料参照《化学药品新注册分类申报资料要求(试行)》(2016年第80号)第二部分注册分类4和5.2类相关要求整理。
(三)和(四)非临床和临床试验资料参照《化学药品新注册分类申报资料要求(试行)》(2016年第80号)相关要求整理。如无,注明不适用。
(2)口服固体制剂:参照CDE 2016年第120号通告附件《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》要求整理,内容框架如下表:
▲ 表4-口服固体制剂一致性评价申报资料目录

4.1.3 境内外原料药申报资料格式
原料药申报资料的格式同样是M4 CTD格式,由于不涉及非临床研究和临床研究,模块四和五不适用,内容框架如下表:
▲ 表5-原料药申报资料目录

申报资料内容参照《化学药品新注册分类申报资料要求(试行)》(2016年第80号)编写。境外生产原料药证明性文件按照注册分类5.2类证明性文件的要求,外文资料应翻译为中文递交。
自2023年1月1日起正式实行电子申报后,原料药递交资料由原来的docx格式改为pdf格式。
4.2 电子申报
自2023.1.1日起正式实行注册资料电子申报,相关要求按照CDE2022.12.02发布的关于药品注册申请电子申报有关要求的通知,注意事项可参考注册圈文章电子申报和电子盖章经验之谈。光盘电子文档结构如下表:
▲ 表6-申报光盘电子文档结构

4.3 光盘和档案袋封面
提交申请表后系统自动生成光盘和档案袋封面,下载打印盖章。
4.4 递交
之前邮寄资料给CDE需提前发送邮件至相关邮箱,现在采用在CDE申请人之窗提交预约信息的方式(现场提交或邮寄快递都需要)。
以上就是这次的分享,希望大家多多指教!

