USP22通过MED1抑制组蛋白H2A单泛素化来控制iNKT免疫
写在前面
今天推荐的是由美国西北大学 Feinberg 医学院病理学系在2020年1月13日发表于Journal of Experimental Medicine(2020IF:14.307,JCRQ1)的一篇文章,通讯作者是Deyu Fang教授,研究表明USP22通过MED1抑制组蛋白H2A单泛素化来控制iNKT免疫。
研究背景
iNKT细胞在连接先天性和适应性免疫反应方面发挥着重要作用,并与传染病、过敏、哮喘、自身免疫和肿瘤监测有关。泛素途径已被证明可调节iNKT细胞免疫,但尚未确定参与该过程的去泛素化酶。
摘要部分
在此,作者发现泛素特异性肽酶22(USP22)在iNKT细胞的早期发育阶段1中高度表达。USP22缺陷以细胞固有方式阻止了iNKT细胞发育过程中从阶段1到2的过渡。USP22抑制也减少了iNKT17和iNKT1的分化,但有利于iNKT2极化而不改变传统的T细胞激活和分化。USP22与Mediator complex subunit 1(MED1)相互作用,MED1是一种参与iNKT细胞发育的转录共激活因子。有趣的是,在与MED1相互作用时,USP22不作为去泛素化酶来抑制MED1泛素化以使其稳定。相反,USP22通过去泛素化组蛋白H2A而不是H2B单泛素化来增强MED1对IL-2Rβ和T-bet基因表达的功能。因此,作者的研究揭示了USP22介导的组蛋白H2A去泛素化微调MED1转录激活,这是一种以前未被重视的控制iNKT发育和功能的分子机制。
研究内容
1.iNKT细胞发育需要USP22
作者首先分析了USP22在T细胞和iNKT细胞中的表达,并检测到其在iNKT细胞中的高表达。进一步分析表明,USP22表达在iNKT发育第1阶段上调,在第2阶段进一步增加,表明USP22可能在iNKT免疫中发挥重要作用。作者通过用Lck-Cre转基因小鼠饲养USP22floxed小鼠(USP22条件突变小鼠)产生了T细胞特异性USP22条件性KO(USP22 cKO)小鼠。进一步的细胞内染色分析表明,来自WT和USP22 cKO小鼠的大部分免疫细胞的比例没有明显变化。有趣的是,流式细胞术分析检测到USP22 cKO小鼠胸腺中TCRβ和NK1.1阳性iNKT细胞群与其WT同窝对照相比减少了90%。使用CD1d-αGalCer四聚体的进一步分析证实了胸腺中iNKT细胞群的减少,表明USP22对小鼠iNKT细胞的产生至关重要。
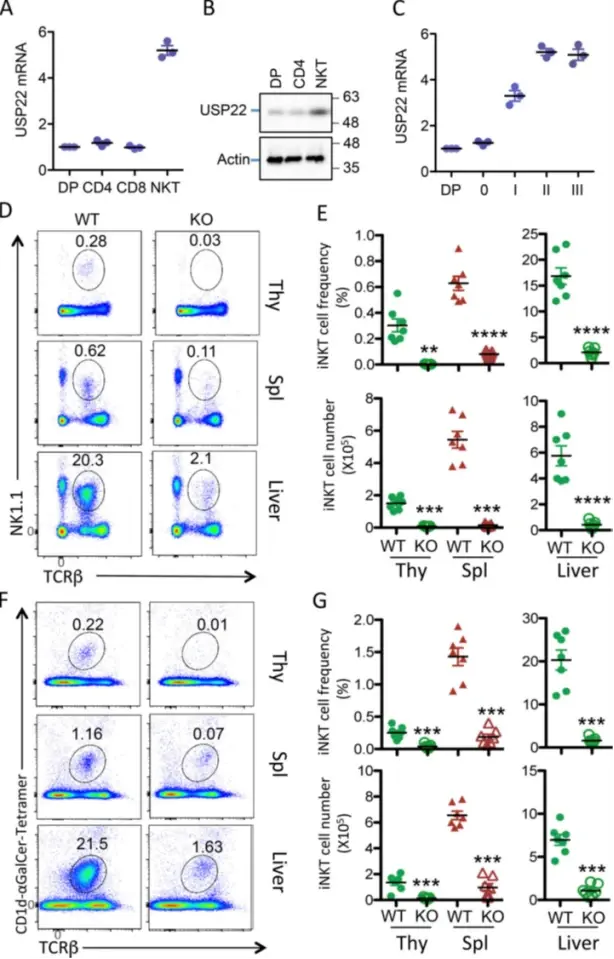
研究结论:iNKT细胞发育需要USP22的参与。
2.USP22以细胞固有方式调节iNKT细胞发育
为了确定USP22是否以细胞固有方式调节iNKT细胞发育,作者通过用CD45.1+ WT和CD45.2+ USP22 cKO骨髓细胞的1:1混合物,将其重构到辐照后的CD45.1+ WT受体中,进而来产生骨髓嵌合体。来自USP22 cKO的供体骨髓细胞即使在WT细胞存在的情况下,也很难在胸腺、脾脏和肝脏中重建iNKT细胞区室。因此,与同一受体中的CD45.1 iNKT细胞相比,胸腺、脾脏和肝脏中CD45.2 iNKT细胞的频率和绝对数量都大大减少。这些研究表明USP22以细胞固有方式调节iNKT的发育。

研究结论:USP22以细胞固有方式调节iNKT细胞发育。
3.USP22在成熟阶段促进iNKT的发展
作者推测USP22缺乏会由于CD1d表达降低而损害iNKT细胞发育;然而,在WT和USP22 cKO小鼠之间,CD4+CD8+胸腺细胞上的细胞表面CD1d表达水平相当。此外,由于USP22功能对癌细胞的增殖和存活至关重要,作者随后探究USP22基因缺失是否导致细胞死亡增加和CD4+CD8+iNKT的生长减少。然而,即使在培养24-72小时后,靶向USP22基因缺失也不会改变膜联蛋白V+CD4+CD8+细胞的百分比。此外,小鼠中USP22缺失未改变BrdU掺入CD4+CD8+DP细胞。这些结果在很大程度上排除了USP22通过促进iNKT前体的生长或存活来促进iNKT细胞发育的可能性。USP22 cKO小鼠胸腺中存在一些残留的iNKT细胞使作者能够进一步表征iNKT发育过程中从早期到后期的转变。与WT胸腺相比,其中1%的CD1d四聚体阳性iNKT细胞处于0期,平均15%的CD1d四聚体阳性iNKT细胞处于USP22 cKO小鼠胸腺中的0期,并且它们的绝对数量没有改变。同样, CD24loCD44loNK1.1的 1期iNKT细胞百分比从2.5%增加到20.5%,它们的绝对数量在WT和USP22 cKO小鼠之间相当。重要的是2期iNKT细胞,它们的绝对数量下降>80%。进一步的分析表明,小鼠中USP22缺失不会改变iNKT细胞发育过程中每个发育阶段的BrdU掺入和膜联蛋白V+凋亡细胞。

研究结论:USP22功能对于从第1阶段到第2阶段的过渡至关重要。
4.USP22功能参与调节iNKT但不参与传统的CD4T细胞分化
接下来,作者分析了USP22缺乏对iNKT分化的影响。有趣的是,作者发现USP22缺乏导致NTK1和NKT17的百分比显着降低。相比之下,NKT2细胞的百分比从15.8%增加到51.3%,表明USP22是NKT1和NKT17分化所必需的,但USP22功能的丧失促进了iNKT细胞向NKT2的分化。为了支持这一观点,通过细胞内染色对Th1细胞谱系特异性转录因子T-bet的分析证实了USP22 cKO小鼠中PLZ Flow Tbet+ NKT1细胞的显着减少。此外,GATA3的细胞内染色检测到USP22 cKO小鼠中PLZFhiGATA3+NKT2细胞显着增加。与降低的百分比一致,USP22 cKO胸腺中NKT1和NKT17的绝对数量显着减少。对谱系特异性细胞因子产生的进一步分析证实,在USP22缺失小鼠中,产生IFN-γ的iNKT1细胞显着减少,产生IL-4的iNKT2细胞增加。

研究结论:USP22在特异性重编程iNKT细胞分化中具有重要作用。
5.USP22抑制H2A单泛素化以表达驱动iNKT发育的基因
为了确定USP22如何调节iNKT细胞发育和功能的分子机制,作者分析了已被证明对iNKT细胞发育、成熟和存活至关重要的基因的表达水平。与WT iNKT细胞相比,实时RT-PCR分析检测到USP22 cKO胸腺iNKT细胞中T-bet和IL-2Rβ的表达显着降低。作者还检测到EGR2和PLZF表达显着增加,这两者都参与促进iNKT细胞发育的早期阶段。作为对照,USP22 cKO iNKT细胞中USP22的mRNA表达完全减少,进一步证实了由Lck启动子驱动的Cre重组酶有效删除USP22基因。然后,作者通过流式细胞术确认了WT和USP22 cKOiNKT细胞中T-bet、IL-2Rβ、PLZF和EGR2蛋白质表达水平的差异。与作者的实时定量PCR(qPCR)分析一致,与WT细胞相比,USP22 cKOiNKT细胞中T-bet和IL-2Rβ的蛋白表达水平显着降低。作者还证实,胸腺iNKT细胞中PLZF和EGR2的蛋白质表达水平因USP22缺失而显着增加。总的来说,作者的数据表明USP22可能至少部分通过调节T-bet、IL-2Rβ、PLZF和EGR2的表达来促进iNKT细胞发育。
作为转录共激活因子组分,USP22经常被招募到靶基因的启动子区域。然后作者测试了USP22是否与在USP22缺失的iNKT细胞中表达发生改变的基因的启动子结合。事实上,通过染色质免疫沉淀(ChIP)测定法检测到USP22与T-bet和IL-2Rβ基因启动子的结合。作者随后使用shRNA介导的敲低方法来敲低DN32.D3细胞中的USP22表达。进一步分析证实,USP22抑制导致T-bet和IL-2Rβ显着减少,但EGR2和PLZF表达升高,正如作者在原代USP22-nulliNKT细胞中观察到的。重要的是,USP22抑制导致T-bet和IL-2Rβ启动子区域组蛋白H2A单泛素化水平显着增加,而不是H2B单泛素化水平,表明USP22促进所需基因的表达通过抑制组蛋白H2A单泛素化来促进iNKT的发展。与作者的发现类似,USP22不会被PLZF和EGR2启动子募集,其启动子上的H2A和H2B单泛素化水平都不会因DN32.D3细胞中的USP22敲低而改变。

研究结论:USP22通过抑制组蛋白H2A单泛素化来调节iNKT细胞基因表达。
6.USP22与iNKT细胞中的MED1相互作用
作者发现USP22与MED1相互作用,MED1是一种转录共激活因子,已被证明对瞬时转染的HEK293细胞中的iNKT发育至关重要。内源性USP22和MED1之间的相互作用在小鼠原代iNKT细胞中得到进一步验证,因为在抗USP22免疫沉淀物中检测到MED1,但在正常兔IgG对照中未检测到,表明USP22可能部分通过与MED1相互作用的方式调节iNKT细胞发育。USP22的缺失会阻止iNKT细胞从第1阶段过渡到第2阶段,而MED1促进iNKT从CD4+CD8+处理器发展到第0阶段过渡。有趣的是,实时RT-PCR分析表明MED1在iNKT发育的所有阶段都是组成型表达的。相比之下,USP22表达在iNKT发育的早期阶段保持在较低水平,并且从第1阶段显着上调,在第2和第3阶段进一步增加。作者比较了泛iNKT细胞中的USP22蛋白表达与CD4+CD8+细胞。与作者的实时RT PCR分析一致,在iNKT细胞中证实USP22蛋白表达增加,但iNKT和CD4+CD8+细胞之间的MED1表达水平相当。这些结果解释了与MED1功能丧失相比,USP22缺陷会在后期损害iNKT发育的原因。然而,USP22表达未能抑制MED1泛素化水平。与这一观察结果一致,USP22表达没有增加MED1蛋白的半衰期。此外,在iNKT细胞中,USP22敲低不会增加MED1蛋白表达水平。因此,USP22不太可能通过MED1稳定来调节iNKT细胞的发育。

研究结论:USP22与iNKT细胞中的MED1相互作用。
7.USP22部分通过MED1调节驱动iNKT发育的基因的表达
由于USP22与MED1相互作用,这两者都是参与促进iNKT细胞中T-bet和IL-2R基因转录的转录共激活因子,作者随后探究MED1是否与USP22依赖的T-bet和IL-2Rβ的启动子结合方式。作者生成了MED1敲低DN32.D3细胞。与USP22敲低DN32.D3细胞相似,MED1抑制显着降低了T-bet和IL-2Rβ基因的表达水平。然而,与USP22敲低不同,MED1抑制不会改变EGR2和PLZF的表达。这些结果表明,USP22以MED1依赖性方式促进T-bet和IL-2Rβ基因转录,但它抑制EGR2和PLZF表达,而不依赖于MED1。值得注意的是,MED1敲低显着降低了USP22与T-bet和IL-2Rβ启动子的结合水平。相比之下,USP22抑制未改变MED1与T-bet和IL-2Rβ启动子的结合。这些结果表明USP22通过MED1相互作用被募集到T-bet和IL-2Rβ启动子。为了支持这一观点,作者进一步检测到MED1敲低DN32.D3iNKT细胞中T-bet和IL-2Rβ启动子的组蛋白H2A单泛素化水平显着增加。
研究结论:USP22部分通过MED1相互作用,调节驱动iNKT发育的基因的表达。
8.Vα14-Jα18 TCR转基因表达可以挽救USP22 cKO小鼠的iNKT细胞缺陷
已经表明,过表达iNKT细胞特异性Vα14-Jα18 TCR基因,可以挽救MED1缺失小鼠中iNKT细胞的发育缺陷。如果USP22可以通过MED1促进iNKT发育,作者假设iNKT细胞特异性Vα14-Jα18 TCR转基因的过表达可以挽救USP22 cKO小鼠中的iNKT发育。因此,作者将USP22 cKO小鼠与在CD4启动子控制下表达Vα14-Jα18 TCR基因的转基因小鼠杂交。事实上,Vα14-Jα18 TCR基因在USP22 cKO小鼠的胸腺、脾脏和肝脏中大大恢复了iNKT细胞的相对比例和绝对数量。Vα14-Jα18 TCR基因表达导致iNKT细胞在早期发育阶段积累,在WT和USP22缺失小鼠的胸腺中也检测到类似的iNKT发育模式。作者还检测到USP22-nullVα14-Jα18 TCR转基因iNKT细胞中T-bet和IL-2Rβ的减少以及PLZF和EGR2的增加说明Vα14-Jα18 TCR转基因表达在很大程度上挽救了USP22缺陷。
基于观察,作者提出了USP22调节iNKT细胞发育和功能的模型。USP22通过与另一种转录辅激活因子MED1的相互作用被募集到T-bet和IL-2Rβ启动子。USP22不是去泛素化和稳定MED1,而是抑制组蛋白H2A单泛素化以促进iNKT发育所需基因的表达。因此,USP22基因的靶向缺失在很大程度上通过阻止其从第1阶段过渡到第2阶段而导致iNKT发育缺陷。

研究结论:Vα14-Jα18 TCR转基因表达在USP22 cKO小鼠中恢复iNKT细胞发育。
结论与讨论
总之,作者的研究确定了遗传辅因子USP22在iNKT发育中令人惊讶的谱系特异性功能。USP22部分通过与另一种转录辅激活因子MED1的相互作用来促进iNKT的发育。抑制USP22去泛素化酶催化活性的特定抑制剂可能在iNKT介导的免疫疾病(包括自身免疫疾病)的治疗中具有一定的潜力。
Thank you!
原文链接:https://doi.org/10.1084/jem.20182218

