【做题】2023北大春联复赛试题解析(1)

注:
① 本试题为北京大学化学与分子工程学院命制,版权归北京大学化学与分子工程学院所有。 本文为原件复制版,由 δ 协会制作;为尽量增强图片的可读性,协会对本文档中题目的插图进行了重绘,希望做到准确无误。 实际情况请以原始文献为准。
② 本文试对无机化学部分进行解析。
③ Up是小萌新,如有问题请佬 / 铑们指出!谢谢awa。

先来看热身题。

不算难题,直接放答案咯:

接下来看看第二题。

这个题我答得不太好。
2-1是一个盐酸环境,其中离子易歧化,Cu(Ⅰ)存在形式为配离子
。Bi(Ⅴ)常见存在形式为铋酸根离子,酸性条件下表现氧化性。故反应式为
。
Cu(Ⅲ)瞬间解离为,瞬间与Cu(Ⅰ)发生归中反应,即
。所以一共有两个反应。
我当时把Cu(Ⅲ)的存在形式写成了。根据Mr. Li(我的老师)的说法,
在固体中能稳定存在,则不用考虑氧酰离子的事。不过这一点可能有点争议,因为我查到一篇文献说“金属和超导氧化物中缺乏
”(如下)。
可能由于做题时信息不足吧,就题干而言Mr. Li所说的的确没问题,所以呀,信息不足时就当最简情况处理好咯!
2-2Cu(Ⅲ)瞬间解离为,没法归中,直接把水氧化,有
。水过量,所以Cu(Ⅲ)无剩余,无后续反应。同时铋酸根离子与Fe(Ⅱ)反应,有
。Fe(Ⅱ)过量,铋酸根离子无剩余,无后续反应。
对于第一个反应,为什么Cu(Ⅲ)不和Fe(Ⅱ)或者氯离子反应?我觉得是因为Cu(Ⅲ)离子必定先与溶剂接触,所以必然优先和水反应(动力学有利)。
接下来2-3直接解方程组即可。参考答案与评标如下。

(插一句:乍一看这个答案可能不明白,但自己把方程列一边就懂了)

然后是晶体题。

3-1,我自己推了一下,大概长这样:

由此个数Ca:Si = 1:1,Si一共4套等同点,则Ca亦然。点阵型式为体心四方,结构基元为Ca4Si4。
3-2,自己数罢,从略咯(却是我不太喜欢的一种题……)。
3-3,Si-Si键长恒定,则硅簇中成Si-Si单键。易得Si的氧化数为-2(),则有2对lp。
3-4,由前几问可知Ca-Si键离子性强,且本文Si最外层有8电子,则可用离子键理解之。平面结构,Si还是三连接的,则可推断Si以六元环形式无隙并置(类似单层石墨结构!!),由于Si化学环境唯一,则Ca位于六元环中心位置。
评标如下。

接下来是第四题,我们一问一问看。

考虑主反应,由于总反应是水分解制氢,所以二氧化硫/碘必然做催化剂,且机理必然包含氧化还原反应。由反应2,因为得到白色沉淀,且反应1为氧化还原反应,则A解离产物含硫酸根离子。由此,B为还原产物,则B中碘氧化数为-1;由元素守恒定律,得知A为硫酸,B为碘化氢。反应3与4为分解反应,则此步释放催化剂,分别是A与B的分解。由此写出方程式即可。(注意,反应2写离子方程式)。评标如下。

接下来看4-2。

4-2-1,由于水分解制氢的要求是温度越低越好(见总题干)且仅从热力学考虑,则考虑各反应达到化学平衡状态时()的反应温度即可。对原曲线适当延长,得:

显然,即体系(2)高价氧化物分解产生低价氧化物和氧气的温度高于水直接分解的温度,而(1)的低于水分解温度。所以体系(1)更适合。
注:反应方向与平衡时温度严格无关。
(为什么?因为平衡移动方向与平衡转化率无关啊……)
4-2-2,

由于图中所给反应均为逆反应,则对于体系(1),当时,水的分解反应在热力学上有利;当
时,氧化物还原反应热力学有利。所以水分解反应温度范围
,氧化物还原反应温度范围
。本问评标如下。

然后是4-3与4-4。

考查锰的化学。首先,即
,碳酸钠过量,水氧化性不强,Mn(Ⅱ)被氧化到
,则
。
然后变酸性环境,。
最后放氧释放催化剂。
注:Mn(Ⅲ)在酸性环境下易歧化,我感觉Mn(Ⅲ)在碱性条件下就以的形式存在罢……

高中必修一的题……
第一步由已知信息,得知。
接下来生成氢气,考虑碱金属性质,。
生成氧气,考虑过氧化物的性质,。
评标如下。

之后是第五题。
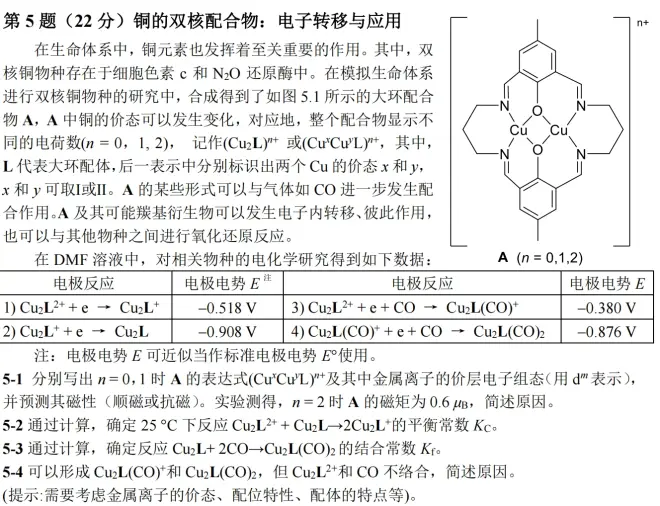
不算难题。只说两点。
5-1②,,解出
,所以Cu(Ⅱ)-Cu(Ⅱ) 之间存在磁作用,且分子内多个磁矩几乎相互抵消,即磁矩倾向于反平行排列。(我当时就写得不太严谨……)
5-4,主要考虑电子组态,考虑CO为强场配体即可,挺开放的结构大题,感觉能说很多东西。
(也欢迎大家贡献下自己的想法捏)

最后是第六题。
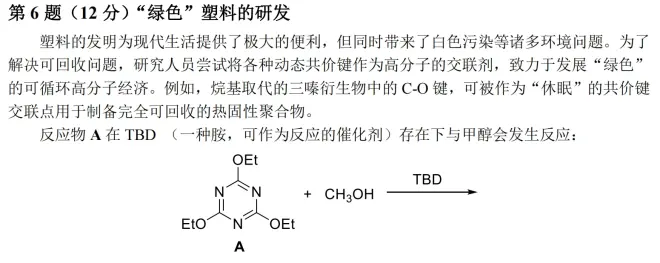
画个重点:“烷基取代的三嗪衍生物中的 C-O 键,可被作为‘休眠’的共价键交联点用于制备完全可回收的热固性聚合物。”由此可推测反应位点在C-O 键处。由于-OR是一个很好的离去基团,所以我们猜测:本反应大概率为取代反应。

6-1,由上文分析,可知大概率三个-OEt均被取代,再加上反应物A(基于常识,有机反应一般没有无机反应进行得那么充分),故一共四种产物。再利用质谱质荷比(m/z值)数据检验即可。
6-2,如图可知,,则本反应为一级反应。将数据代入Arrhenius方程的积分式即可,从略。
6-3①照葫芦画瓢即可;②被补全方程式的产物中有EtOH,所以可在TBD作用下加入过量乙醇拉动平衡逆移。(当然我自以为我这么说没问题)
本题评标如下。

当然6-3的n-聚合符号是我加上去,我觉得应该加,但原答案没写……
还是那句话,若有错请指出!阿里嘎多……
To be continued …
(2023年7月12日)

