文献解读|单细胞测序揭示胃癌肿瘤微环境中活性细胞亚型及其相互作用

期刊:Theranostics 11.56分
测序技术:单细胞转录组测序,空间转录组测序
导语
胃癌仍然是全球癌症相关死亡的第三大常见原因。开发新的胃癌治疗策略需要深入了解胃癌的肿瘤细胞和微环境。对9名未经治疗的非转移性胃癌患者进行了单细胞RNA测序,Tregs细胞在胃肿瘤组织中显著富集,免疫抑制相关基因的表达增加,这表明存在更多的免疫抑制微环境。观察CD8+T细胞簇,以及耗竭标记物PDCD1、CTLA4、HAVCR2、LAG-3和TIGIT在这些特定细胞中的低表达水平。这些可能是胃癌患者免疫治疗获益有限的分子水平证据。此外,发现ACKR1在肿瘤内皮细胞中特异性表达,与不良预后相关,并可能提供胃癌治疗的新发现。此外,内皮细胞和成纤维细胞之间的紧密相互作用暗示了成纤维细胞在肿瘤血管生成和维持肿瘤血管系统中的重要作用。
研究结果
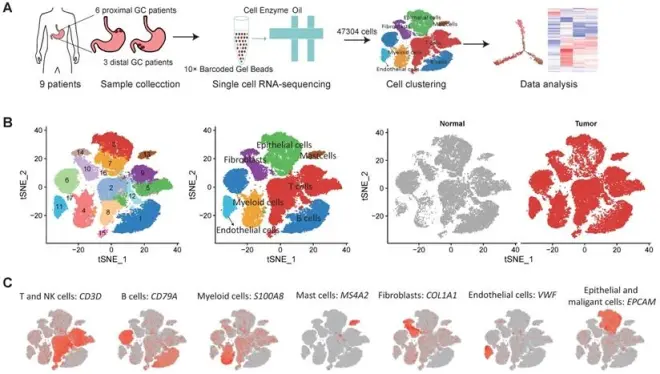
1. 单细胞RNA测序确定胃癌的七种主要细胞类型
9例未经治疗的非转移性胃癌患者的新鲜肿瘤样本和邻近非肿瘤样本,其中6名患者患有近端胃癌(标记为P01-P06),3名患者患有远端胃癌(标记为D01-D03)。共获得47304个细胞,可检测到200多个基因的表达,可以使用基于图的聚类获得17个细胞簇(图1B)。基于典型标记基因的表达和这些簇顶部不同表达的基因,研究将这些簇分为七种主要细胞类型,包括T细胞和NK细胞(6簇)、B细胞(2簇)、髓样细胞(2簇)、肥大细胞(1簇)、成纤维细胞(3簇)、内皮细胞(1簇)、上皮细胞和恶性细胞(3簇)。
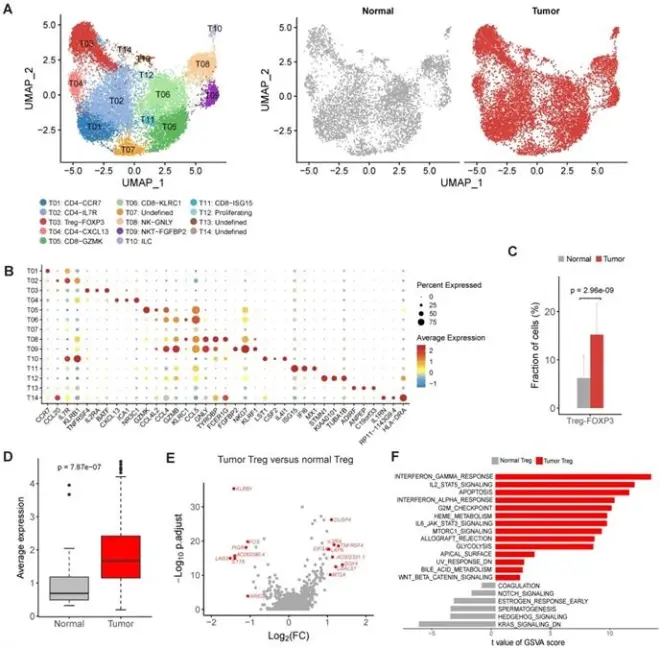
2. 胃肿瘤中调节性T细胞的显著扩增
接下来,对T细胞和NK细胞进行重新分类,确定了14个不同的簇(图2A)。基于典型标记基因的表达和每个簇的最高差异表达基因(图2B),研究将这些簇注释为调节性T细胞、CD4+T细胞、CD8+T细胞、自然杀伤细胞和固有淋巴细胞(ILC)。对于CD4+细胞簇,T01被表征为具有CCR7特异性表达的天然CD4+T细胞。根据特异性表达的CXCL13,T04被归类为滤泡帮助T细胞,并且该簇增加了PDCD1和TIGIT的表达,表明处于耗尽状态。Treg信号基因在肿瘤样本中表现出一致的高表达(图2D)。与正常Treg相比,肿瘤Treg增加了与免疫抑制相关的多个基因的表达,包括DUSP4、IL2RA、TNFRSF4、LAYN和LGALS1(图2E)。肿瘤中Treg比例的增加,以及这些基因和通路的表达上调(图2F),这表明胃肿瘤微环境的免疫抑制性质。
3. 胃肿瘤中巨噬细胞的异质性
为了测试此处确定的巨噬细胞亚群是否符合经典M1/M2模型,评估了这些巨噬细胞亚型的M1和M2特征的表达,结果显示,INHBA+簇(M08)和ISG15+簇(M11)表现出更高的M1特征,而C1QC+簇(M9和M10)表现出更高的M2特征(图3A),这表明胃肿瘤中巨噬细胞的体内极化不能用M1/M2模型来解释。在比较TAMs和C1QC+巨噬细胞的基因表达水平时,在INHBA+巨噬细胞中识别出49个上调基因,包括多种趋化因子,IL6,PTGS2,IL1RN和TIMP1(图3B)。在树状图中,INHBA+TAM和单核细胞位于单个分支中,这意味着该簇可能起源于肿瘤区域的浸润单核细胞(图3D),并且免疫浸润分析表明,在INHBA+TAM中,多种转录因子的活性特异性上调,包括RELB、NFKB1、NFKB2等。

4. 内皮细胞和成纤维细胞在肿瘤血管生成中的相互作用增强
研究使用DB2,确定了肿瘤和正常样本中由各种配体和受体对介导的潜在细胞间相互作用,在正常样本中,三类髓样细胞中的细胞间相互作用略微富集(图4A)。内皮细胞和成纤维细胞之间的紧密相互作用表明,成纤维细胞与肿瘤血管生成和肿瘤血管系统的维持密切相关。除此之外,当检查不同内皮细胞亚群和成纤维细胞的细胞间相互作用时,研究发现EC-ESM1(尖端样内皮细胞)与四个成纤维细胞亚群(F01-F04)具有强烈的相互作用(图4B)。EC-ESM1与这四个成纤维细胞亚群的相互作用主要由PGF、VEGFA、PDGF基因及其受体介导(图4C),这些基因是血管生成的已知驱动因子。但是,FLT1和PGF的相互作用仅在EC-ESM1和Fib-RGS5中观察到,而在其他对内皮细胞和成纤维细胞簇中没有观察到。总之,内皮细胞和成纤维细胞相互作用的增强是胃癌细胞间相互作用的根本改变。

参考文献:
Single-cell landscape reveals active cell subtypes and their interaction in the tumor microenvironment of gastric cancer 2022; 12(8): 3818-3833. doi: 10.7150/thno.71833.

