【高中化学必修二】化学反应与能量合集 |0基础起步!

化学反应与热能
一.吸热反应与放热反应

- 概念:放热反应:释放热量的化学反应。
吸热反应:吸收热量的化学反应。
2.常见的放热反应
金属与水或酸的反应,燃烧反应,大多数的化合反应,酸碱中和反应
3.常见的吸热反应
氢氧化钡晶体与氯化铵的反应,盐酸与碳酸氢钠的反应,大多数的分解反应,炭做还原剂的反应
二.以化学键和总能量的角度分析化学反应的能量变化
- 化学反应的本质与特征

- 化学反应能量变化

- 以氯气和氢气的反应为例

- 化学键与反应的能量变化

三.化学反应的能量变化图像

原电池基本概念
- 火力发电的能量变化

- 原电池——化学能直接转化为电能

- 原电池
- 定义:利用氧化还原反应原理,将化学能转化为电能的装置。
- 电极名称
- 负极 电子流出,发生氧化反应的电极
- 正极 电子流入,发生还原反应的电极

3.构成条件
理论上,自发的氧化还原反应均可构成原电池
具体条件
- 具有活动性不同的两个电极(金属与金属或金属与能导电的非金属)
- 溶液:两电极均插入电解质溶液中
- 导线:两电极用导线相连,形成闭合回路
4.例题

化学电池
- 概念:化学电池是根据原电池原理,将化学能转变为电能的装置。
- 分类:可分为一次电池,二次电池和燃料电池
- 一次电池:放电后不能再充电使其复原的电池(内部氧化还原反应无法逆向进行)
- 二次电池:又称为充电电池或蓄电池,放点后可以再充电,可以多次重复使用
- 燃料电池:利用燃料和氧化剂之间发生氧化还原反应,能连续的将化学能转换成电能的化学电池,如氢氧燃料电池,甲醇燃料电池
一.一次电池-锌锰干电池

- 石墨棒只导电不反应,二氧化锰是氧化剂被还原
二.二次电池-铅酸蓄电池

- 负极为铅,正极为二氧化铅。
- 放电过程中,铅和二氧化铅都变为硫酸铅(正极负极在放电过程中质量都增加,电解液硫酸的物质的量浓度降低)充电时正好相反。
三.燃料电池-氢氧燃料电池

- 要背电极反应式
化学反应速率
一.化学反应速率的含义与表达方法
- 定义:化学反应速率是用来衡量化学反应进行快慢程度的物理量。
- 表示方法:通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。
- 计算公式与单位

4.固体纯液体的浓度视为定值(在一定温度下),不因其质量或物质的量的增减而变化,所以不能用固体和纯液体的浓度变化来表示反应速率。
二.化学反应速率的换算与比较
1.对于同一个反应来说,用不同物质来表示该反应速率时,其数值可能不同,但表达的意义是相同的。因此,表达化学反应的速率时,必须指明是用反应体系中的哪种物质做标准。

2.在同一反应中用不同的物质来表示反应速率时,其数值之比等于各物质的化学计量数之比。

- 例题

三.影响化学反应速率的因素
- 探究温度对反应速率的影响

- 探究反应物浓度对反应速率的影响

- 探究催化剂对反应速率的影响

- 探究固体反应物的表面积对反应速率的影响
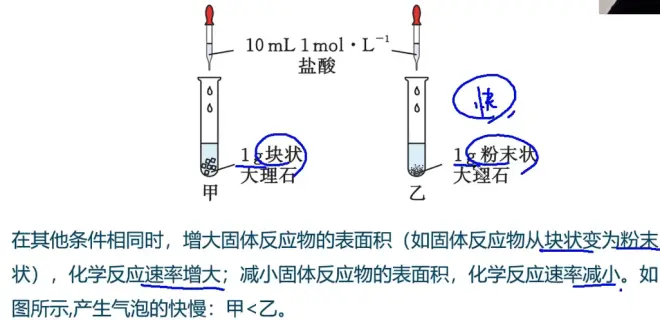
- 例题1

- 例题2

四.压强对反应速率的影响
有气体参加的反应:改变压强对反应速率的影响实质是改变体积,使反应物的浓度改变。
- 压缩体积或充入气态反应物,使压强增大,都能加快反应速率。
- 充入非反应气体(无关气体)对化学反应的影响
- 恒温恒容时:充入无关气体-压强增大,但各物质浓度不变-反应速率不变。
- 恒温恒压时:充入恒温气体-压强不变-体积增大-各物质浓度减小-反应速率减慢。

化学反应限度
一.可逆反应
- 在相同条件下能向正反应方向进行同时又能向逆反应进行的反应称为可逆反应。
- 特征:
- 双向性:指可逆反应分为方向相反的两个反(正反应和逆反应)
- 双同性:指正逆反应是在同一条件下同时进行的
- 共存性:指反应物的转化率小于百分之百,反应物与生成物共存。

3.有些化学反应能进行得比较彻底(非可逆反应)
有些化学反应是不能进行彻底的(可逆反应)
可逆反应不能进行到底,存在一定的化学反应限度
二.化学平衡状态的建立

三.化学平衡状态
如果外界条件(温度浓度压强等)不发生改变,当可逆反应进行到一定程度是,正反应速率与逆反应速率相等,反应物与生成物的浓度不再改变,达到一种表面静止的状态称为“化学平衡状态”,简称化学平衡。

四.化学平衡状态的判断
- 定义:v正=v逆
- 变量不变,极达平衡

五.化学反应条件的控制
- 控制化学反应条件的意义
促进有利反应(提供反应物的转化率及原料的利用率,加快反应速率等)
抑制有害反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生)
- 控制化学反应条件的方法
- 改变化学反应速率
- 改变可逆反应进行的程度
- 合成氨工业反应条件的控制

- 煤燃烧反应条件的控制
- 将固体煤粉碎以增大接触面积,同时空气适当过量,以提高转化率。
- 炉膛材料尽量选择保温性能好的,烟道废气中的热量用来加热水,发电等,以提高热量利用率。

- 例题

原电池电极反应式的书写
一.原电池的电极反应是书写步骤

二.电极反应式书写-甲烷燃料电池

三.电极反应式书写-甲醇燃料电池

四.生物燃料电池

五.电极反应式书写-非水溶液电解质
- 例题一

- 例题二

六.电极反应式书写-锂离子电池

- 炭只导电不反应


