AD大脑中3-o-硫酸乙酰肝素增加与遗传风险基因HS3ST1相关
HS3ST1是与阿尔茨海默病(AD)相关的遗传风险基因,在AD中过表达,但其在AD病理进展中的具体作用尚不清楚。2023年5月26日,来自北卡罗来纳大学的研究人员在《Science Advances》上发表了题为“Increased 3- O-sulfated heparan sulfate in Alzheimer's disease brain is associated with genetic risk gene HS3ST1”文章,采用LC-MS/MS方法对AD和其他退行性脑疾病患者大脑中肝素硫酸酯(HS)进行了分析,发现AD组中特定的3-O-硫酸化HS的含量增加了七倍。
此外,通过对重组硫酸转移酶修饰的HS和基因敲除小鼠的HS进行分析,研究人员发现特定的3-O-硫酸化HS是由HS3ST1基因编码的3-O-硫酸转移酶亚型1(3-OST-1)所合成,且带有特定3-O-硫酸化区域的合成十四糖(14-mer)抑制了tau蛋白的细胞内摄取。这一发现表明,HS3ST1基因的过度表达可能增强了tau病理的传播,为AD提供了一个潜在的治疗靶点。

研究人员通过肝素酶的降解和LC-MS/MS分析测定3-O-硫酸化HS的水平。通过混合13C标记的校准物和HS多糖进行肝素酶消化,识别和定量了3-O-硫酸化四糖和非3-O-硫酸化二糖。使用这些方法,研究人员得出了不同疾病组和对照组之间特定3-O-硫酸化四糖标记物数量的变化,并提供了关于神经退行性疾病相关HS的重要信息。
在AD患者脑组织中检测到了高水平的3-O-硫酸化HS
通过上述方法,研究人员对不同神经退行性疾病组和健康组的脑组织进行了3-O-硫酸化HS水平的分析,发现特定的3-O-硫酸化四糖标记物在疾病组与对照组之间存在数量变化,特别是在AD组中Tetra-1的数量显著增加。这揭示了与神经退行性疾病相关的3-O-硫酸化HS的变化,为进一步研究疾病机制和潜在治疗靶点提供了重要线索。
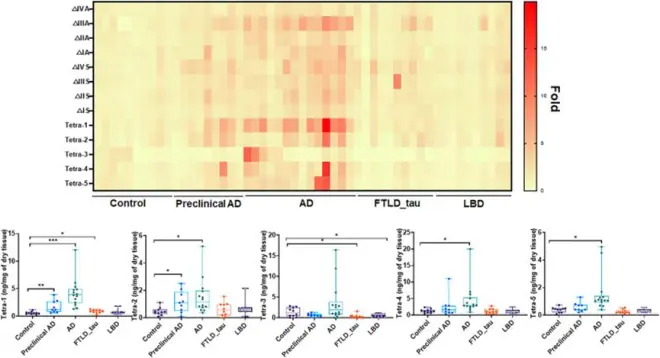
图1:神经退行性疾病脑组织HS成分分析
2.3-OST-1是合成Tetra-1域的关键同工酶
在体外条件下使用不同的3-OST同工酶对HS进行修饰,研究人员分析了3-O-硫酸化四糖的水平。通过LC-MS/MS分析,研究人员确定了不同同工酶产生的3-O-硫酸化结构域的数量。结果显示:3-OST-1是产生Tetra-1的主要同工酶,而其他同工酶主要生成Tetra-4。此外,研究人员还观察到不同同工酶对其他3-O-硫酸化结构域的生成也存在差异。
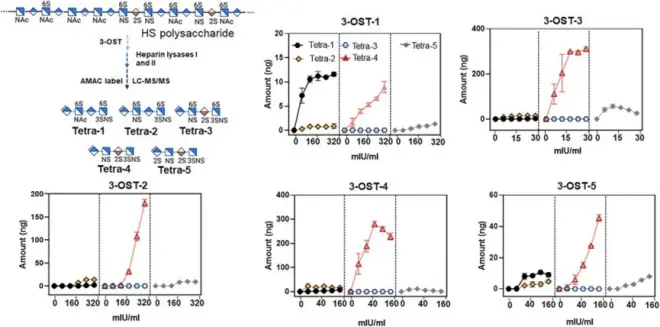
图2:经3-OST异构体修饰后HS中3-o-硫酸化四糖的量
为了研究体内3-OST-1和3-OST-3修饰的HS结构,研究人员进一步比较了来自野生型、3-OST-1基因敲除小鼠和3-OST-3基因敲除小鼠的动物组织中的HS。与野生型相比,3-OST-1基因敲除小鼠的Tetra-1水平显著降低,而3-OST-3基因敲除小鼠的Tetra-1水平没有明显变化,这再次证实了3-OST-1是合成大脑HS中Tetra-1结构域的关键同工酶。研究人员还发现野生型小鼠的大脑中没有Tetra-3,但在肝脏中存在,这表明3-O-硫酸化HS的糖序列具有独特的组织分布。总之,这些数据表明:在AD患者中,大脑HS中Tetra-1水平的升高与3-OST-1酶活性的上调有关。
3.3-O-硫酸化14-糖链抑制了tau的细胞内摄取
研究人员合成了两种具有不同结构的十四糖链(14-mers),利用体外细胞实验研究了3-O-硫酸化HS对tau细胞内摄取的影响。结果显示:具有Tetra-1结构域的14-mer-2比不含该结构域的14-mer-1对抑制tau摄取到小鼠肺内皮细胞系具有更强的效果。此外,研究人员还发现MLE细胞的HS中含有Tetra-1结构域,表明携带该结构域的HS可能与tau的结合和细胞内摄取密切相关。采用LC-MS/MS方法对AD和其他tau病理学患者的大脑HS进行分析,研究人员解决了AD遗传变异是否与HS结构变化相关的问题,确定了HS3ST1基因编码的3-OST-1酶与特定的3-O-硫酸化HS结构域之间的关系,通过在小鼠中进行基因敲除和合成实验,研究人员也证实了3-O-硫酸化HS能够抑制tau的细胞内摄取,这为AD的治疗提供了潜在的治疗靶点。
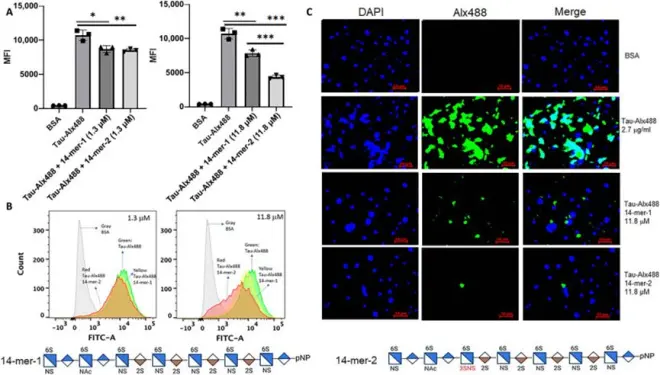
图3:14-mers对tau细胞内化的抑制作用
讨论
这项研究通过检测AD和其他神经退行性疾病大脑中3-o-硫酸盐HS的水平,并对特定的HS区域进行探究,发现3-O-硫酸化HS在AD进展中的作用,而HS3ST1基因则负责携带Tetra-1结构域的特异性3-o-硫酸化HS的合成。该研究结果有助于理解AD潜在的分子机制,3-o-硫酸化HS可能作为改善AD和早期诊断的新靶点。
参考文献:
Wang Z, Patel VN, Song X, et al. Increased 3-O-sulfated heparan sulfate in Alzheimer's disease brain is associated with genetic risk gene HS3ST1. Sci Adv. 2023;9(21):eadf6232. doi:10.1126/sciadv.adf6232
编译作者: zouki (Brainnews创作团队)
校审: 悟空 (Brainnews编辑部)


