【知识摘抄】真核生物蛋白质的定向运输*
真核生物蛋白质的定向运输又称定向转运、靶向输送(targeting)、分选(sorting),是指新合成的蛋白质从合成场所定向运输到功能场所的过程。
真核细胞中合成的蛋白质可分为三类,其中两类涉及定向运输:
①游离核糖体合成的细胞质蛋白和线粒体、叶绿体核糖体合成的蛋白质,不涉及定向运输。
②游离核糖体合成的细胞核蛋白、线粒体蛋白、过氧化物酶体蛋白及内质网核糖体合成的溶酶体蛋白、膜整合蛋白,经历细胞内定向运输。
③内质网核糖体合成的分泌蛋白(secretory protein),经历定向运输和分泌。
例如,酵母有6000多种蛋白质(包括5000种可溶性蛋白质、1000种膜蛋白),其中有1/2为细胞质蛋白,1/4为细胞核蛋白,1/4为线粒体、内质网、高尔基体蛋白。
蛋白质的定向运输可分为两个阶段:
①蛋白质向相关区室运输,通常在蛋白质合成过程中或合成结束时进行。不同的蛋白质在这一阶段分别进入内质网、线粒体或细胞核等。
②运输到内质网的蛋白质进一步进入分泌途径。高尔基体蛋白、溶酶体蛋白和细胞膜蛋白都以运输小泡形式通过分泌途径运输。
一、进入内质网腔
分泌蛋白的合成是在游离核糖体上开始的,后由信号肽引导核糖体锚定于内质网膜胞质面并继续合成,且新生肽直接进入内质网腔,即合成与运输同时进行,该过程称为共翻译运输(cotranslational translocation),例如胰腺细胞分泌的酶、浆细胞分泌的抗体、小肠杯细胞分泌的黏蛋白、内分泌腺分泌的多肽类激素、各组织细胞分泌的细胞外基质成分。游离核糖体和内质网核糖体是一样的,新生肽进入内质网腔由四种其他成分决定。
1.信号肽(signalpeptide) 经历定向运输的蛋白质的特点是都含有信号肽(又称信号序列。Blobel因于1971年提出阐明蛋白质运输和定位的信号学说而获得1999年诺贝尔生理学或医学奖)。溶酶体、线粒体、内质网蛋白前体的信号肽通常位于肽链的N端,功能是引导这些蛋白前体向相应场所运输,之后被切除。细胞核蛋白的信号肽位于肽链的内部,功能是引导其运输入核,之后不被切除。
信号肽(signalpeptide)、信号序列(signalsequence) 蛋白质一级结构中决定其去向或归宿的一段氨基酸序列。
前导肽(leaderpeptide)
①同信号肽。
②原核生物操纵子前导序列编码产物,参与基因表达调控。
转运肽(transitpeptide) 由染色体基因编码的细胞器(线粒体、过氧化物酶体、顶置体、叶绿体、蓝色小体等)蛋白的信号肽。
前肽(propeptide) 在翻译后修饰时被切除的氨基酸序列,如胰岛素C肽。部分中文文献也译作前导肽。
控制共翻译运输的信号肽长13~36AA,位于(或靠近)新生肽N端,有以下特征:
①有的信号肽N端有1~2个带正电荷的碱性氨基酸。
②中间有10~15个疏水性氨基酸。
③C端为蛋白酶剪切位点,含极性氨基酸,靠近剪切位点处为小分子量氨基酸。分泌蛋白信号肽的功能是引导新生肽进入内质网,之后被切除,所以成熟的分泌蛋白没有信号肽(图4-17)。

鸡卵清蛋白例外,其mRNA翻译成的新生肽386AA,信号肽是His22~Asp48,不在N端,最后也未被切除。卵清蛋白的另一个特点是其Ser165、237、321会缓慢改变L-构型为D-构型,并赋予其热稳定性。
2.信号识别颗粒(signalrecognitionparticle,SRP) 是控制共翻译运输的信号肽受体蛋白。信号识别颗粒可与信号肽结合,从而与含该信号肽的新生肽结合。新生肽一旦与信号识别颗粒结合,便向运输通道(channel)移动,穿过运输通道进入细胞器。许多新生肽的运输过程不可逆,即不会再回到细胞质,因为运输过程与释能过程(如ATP水解)偶联,且运输到位之后信号肽通常被切除。
信号识别颗粒是一种核蛋白:
①人信号识别颗粒由六种蛋白质(SRP54、SRP19、SRP68、SRP72、SRP14、SRP9)和一种7S RNA构成。其中7S RNA也记作7SL RNA,属于胞质小RNA,长度为300nt;SRP54是一种GTPase,含两个结构域:G结构域结合GTP,M结构域结合7SRNA(需SRP19协助)和信号肽。
②原核生物信号识别颗粒由一种蛋白质和一种4.5S RNA(平均长度为100nt)构成。
③信号识别颗粒的功能是在结合GTP时与新合成的信号肽及核糖体结合,引导它们向内质网转移,与停靠蛋白结合。
3.停靠蛋白(dockingprotein) 又称信号识别颗粒受体(SRP receptor),是一种内质网膜整合蛋白、一种αβ二聚体,其α亚基有GTPase活性。停靠蛋白的功能是在结合GTP时募集信号识别颗粒-新生肽-核糖体-mRNA复合物,引导它们向转运体转移。
4.转运体(translocator) 又称易位子(translocon)、易位蛋白质,是一种内质网膜蛋白,跨膜异三聚体,记作SEC61αβγ,功能是作为新生肽通道,在与核糖体结合时开放,介导新生肽进入内质网腔。
5.分泌蛋白共翻译运输机制
①核糖体合成信号肽。
②核糖体通过信号肽募集信号识别颗粒。
③信号识别颗粒与GTP结合并中止肽链合成(因为封闭了延伸因子结合位点),此时新生肽长约70AA(肽链过长不利于运输);mRNA-核糖体-新生肽-信号识别颗粒·GTP向内质网移动,被内质网膜停靠蛋白(结合有GTP)募集。
④核糖体与核糖体受体、贯穿内质网膜的转运体结合,转运体开放,信号肽引导新生肽通过,同时信号识别颗粒和停靠蛋白水解各自的GTP,信号识别颗粒释放。
⑤新生肽继续合成,并通过转运体进入内质网腔(消耗ATP),信号肽被内质网中与转运体结合的信号肽酶(signal peptidase,又称前导肽酶。人信号肽酶是一种跨膜五聚体)切除。
⑥新生肽继续合成,直到终止。
⑦核糖体解聚,转运体关闭,新生肽在内质网中修饰(图4-18)。

分泌蛋白在内质网中修饰后,以运输小泡(transport vesicle)形式向高尔基体顺面(顺面高尔基网)运输,在高尔基体内进一步修饰(包括O-糖基化、N-寡糖加工),再以分泌小泡形式离开高尔基体反面(反面高尔基网),运输到细胞膜,通过胞吐作用分泌到细胞外。
二、插入内质网膜
内质网膜、高尔基体膜、溶酶体膜和细胞膜的跨膜蛋白都是在内质网上完成合成的,合成之后的运输途径与分泌蛋白的运输途径一致。跨膜蛋白在整个运输过程中始终呈跨膜状态,不会改变与膜的相对取向。因此,跨膜蛋白最终的跨膜取向早在插入内质网膜时就确定了。
跨膜蛋白分为四类(图4-19),这里以Ⅰ型单次跨膜蛋白为例介绍其嵌膜机制。

所有Ⅰ型跨膜蛋白(如LDL受体)都含N端信号肽和一段约22AA的内部疏水肽段(称为信号锚定序列,signal-anchor sequence,停止转移序列,stop transfer sequence,即跨膜区序列),N端信号肽引导跨膜蛋白向内质网移动,信号锚定序列则为跨膜α螺旋。Ⅰ型跨膜蛋白的N端信号肽和分泌蛋白的信号肽一样,通过信号识别颗粒与停靠蛋白结合,启动共翻译运输:
①新生肽N端进入内质网腔,信号肽被切除。
②新生肽继续合成并进入内质网腔。
③信号锚定序列进入转运体通道,跨膜转运终止。
④信号锚定序列从转运体的亚基之间挤出,插入双层膜结构。
⑤新生肽继续合成,核糖体仍然与转运体结合,但转运体已经关闭。
⑥合成终止,核糖体脱离转运体,跨膜蛋白C端位于内质网表面(图4-20)。之后跨膜蛋白所在膜片出芽形成运输小泡,最终运输到功能场所。

三、进入线粒体
人心肌线粒体蛋白质组有615种蛋白质,仅13种由mtDNA编码,其余均由染色体DNA编码,在细胞质中翻译合成,合成之后才向线粒体内运输,称为翻译后运输(post-translational transport)。
1.线粒体蛋白信号肽 又称转运肽(transit peptide),对于在细胞质中合成的线粒体前体蛋白,其转运肽位于N端,长20~55AA,并无序列保守性,但有以下特征:
①富含疏水性氨基酸、碱性氨基酸(特别是精氨酸)和羟基氨基酸(丝氨酸、苏氨酸),几乎不含酸性氨基酸。
②有两亲性α螺旋(又称两亲螺旋)构象,即疏水性氨基酸和碱性氨基酸分别位于α螺旋的两个侧面。
③没有特异性,可以引导其他蛋白质进入线粒体。
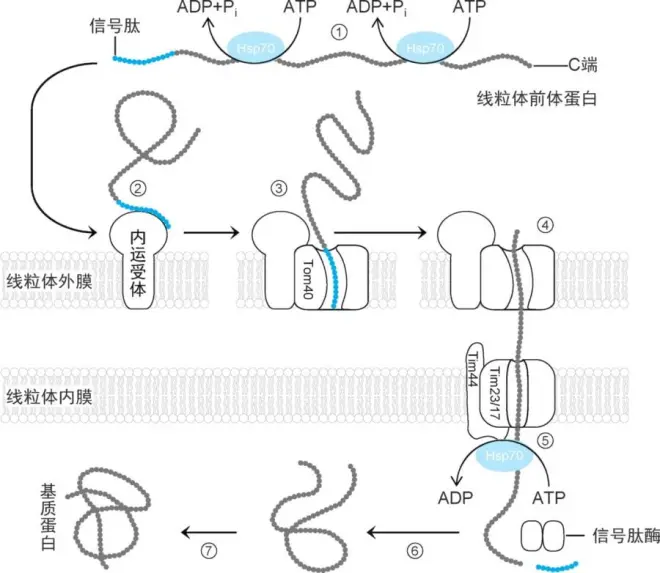
2.线粒体蛋白运输机制
①新合成的线粒体前体蛋白与分子伴侣 Hsp70(或MSF)结合,呈伸展状态(否则不能运输)。
②线粒体前体蛋白与线粒体外膜上的内运受体结合。
③内运受体(Tom20/22)将线粒体前体蛋白向线粒体内外膜接触点(contact point)转移。
④线粒体前体蛋白由转运肽引导,穿过外膜TOM复合体(translocase of the outermembrane,TOM complex)Tom40和TIM复合体(translocase of the innermembrane,TIM complex)Tim23/17。
⑤结合在内膜 Tim44 上的分子伴侣 Hsp70与线粒体前体蛋白结合,通过水解ATP提供能量促使其内运。内运动力还来自跨线粒体内膜的质子动力。
⑥线粒体前体蛋白的转运肽被线粒体加工肽酶(mitochondrial processing peptidase,MPP,αβ二聚体)切除。
⑦线粒体蛋白形成活性构象(多数需要线粒体伴侣蛋白协助)(图4-21)。
线粒体蛋白以线粒体基质蛋白为主,此外还有内膜蛋白、外膜蛋白、膜间隙蛋白。后三类蛋白质均含相应的靶向序列,由相关运输系统通过各自的运输机制完成运输。
四、进入细胞核
真核生物每分钟都有上百万个大分子进出细胞核。细胞核与细胞质之间的物质运输涉及大分子穿孔:
①RNA从细胞核到细胞质。
②新生核糖体蛋白从细胞质到细胞核。
③在细胞核内组装的核糖体亚基从细胞核到细胞质。
此外,在细胞质中合成并向细胞核转运的还有其他细胞核蛋白,如DNA聚合酶、RNA聚合酶、组蛋白和非组蛋白(特别是转录因子)等。
真核生物细胞分裂时发生核膜破裂和重建(remodeling),细胞核蛋白也发生弥散和再聚,因此细胞核蛋白的信号肽——核定位信号(又称核定位序列,NLS)并不切除。NLS可以位于一级结构的不同位点,差异很大,多数含4~8AA,富含(连续的)碱性氨基酸(表4-13)。
表4-13 细胞核蛋白核定位信号和核输出信号
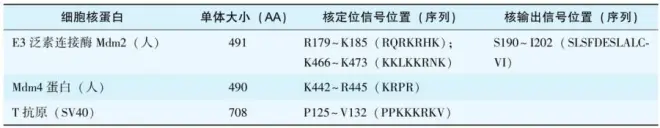
有些蛋白质会因代谢条件变化而在细胞核与细胞质之间穿梭,这种蛋白质还需要核输出信号(NES),例如人糖皮质激素受体、E3泛素连接酶Mdm2(表4-13)。
1.参与细胞核蛋白运输的蛋白因子 种类繁多,其中包括:
①输入蛋白(importin):又称输入因子、核转运蛋白,一类αβ二聚体,是细胞核蛋白的可溶性受体,其α亚基可识别细胞核蛋白核定位信号。
②Ran:一种小分子GTPase(215AA,信号转导的分子基础)。
2.细胞核蛋白运输机制
①在细胞质中,输入蛋白与细胞核蛋白核定位信号结合,形成细胞核蛋白-输入蛋白复合物。
②细胞核蛋白-输入蛋白复合物通过核孔复合体(nuclear pore complex,NPC)进入细胞核。
③Ran·GTP促使输入蛋白与细胞核蛋白分离。
④Ran·GTP-输入蛋白通过核孔复合体回到细胞质。
⑤位于核孔复合体 胞质面的GTP酶激活蛋白(GAP,信号转导的分子基础)激活Ran·GTP,使其水解GTP,成为Ran·GDP,从而与输入蛋白分离,输入蛋白继续运输细胞核蛋白。
⑥Ran·GDP返回细胞核内,由鸟苷酸交换因子(GEF,信号转导的分子基础)协助释放GDP,结合GTP(图4-22)。

*唐炳华,郑晓珂.分子生物学(第3版)[M].北京:中国中医药出版社,2016.

