高中化学基础与解法全集(涵盖所有)|长期更新|从零开始拯救所有学渣!

高二的笔记,从选必1开始
第一课

酸碱稀溶液最好,比热容与水相同
c=4.18×10负三次方kj
以下是课程85—89中一些做题典例和知识点
(复习月考一时整理的,第二课在下面)
2课
盖斯定律:只看起点和中点
方程式→▲H
n倍 n倍
逆写 等值异号
相加 相加
计算反应热:
1:观察最后形成的化学方程式
2:观察之前的化学方程式。如果之前的化学方程式等号左边和最后形成的化学方程式等号左边 出现 同一物质,这个之前的化学方程式不变,如果发现有相同物质,但是在等号的不同侧,那么就要逆写这个最后形成的化学方程式。
3:相加
4:相互消除重复的物质
5:▲H相加
attention:
1:之前的化学方程式看到等号左右两边有相同物质直接消去,方便计算
2:发现 正在观察的 物质 在前后两个方程式 中前面的化学计量数不一样时,需要乘 或除 让之前的化学方程式中 的物质 前计量数 与 最后的化学方程式中 物质的 计量数相等。
3:发现原来的方程式中有很突兀的物质,慎重对待。
4:先抓只出现一次的物质。
5:绝对一看就会,一做就错,祈祷nia少年,坚持刷题才是真理。
能量图做题技巧:
1:先看图,找到能量差,反应物的能量-生成物的能量
2:观察图是放热还是吸热。放热▲H为负。吸热为正。
3:把2里面的负号or正号安到1的能量差头上,即为▲H
4:然后写热化学反应方程式。
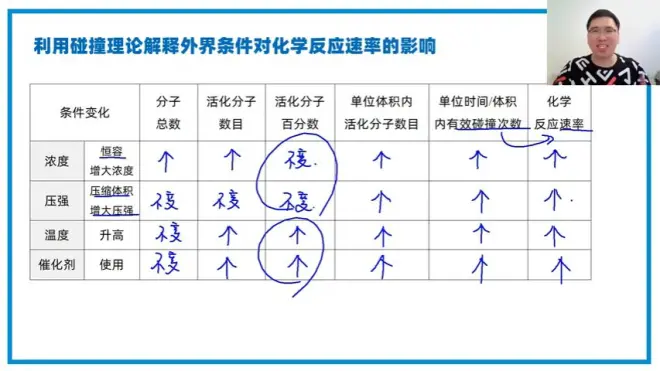
3课:化学反应速率
公式:V=▲C/▲t
⬇
浓度变化量(正值)
attention:1:不用纯液体和固体来表示化学反应速率,水和固体的浓度不会变化太多啦
2:快慢全正现象迷,表示变化和平均
数值速率没联系,固体液体哒咩哟
(一些选填奇妙口诀,没啥用图一乐)

3:化学反应速率有多种表示方法,压强啥的也可以表示化学反应速率。
化学反应速率与化学计量数的关系
1:同一反应用不同物质表示化学反应速率时,其数值大小一般不一样,但表达意义相同。
2:单位相同时,化学反应速率的比值等于每个物质化学计量数的比值。

题型
1:化学反应速率大小比较
用题目中所给出的该物质的化学反应速率除以题目中给出的该物质的化学反应式中的计量数。 之后比较这些数值的大小,从而判断化学反应速率的大小。(老师讲的可,我觉得麻烦)
三段式法:我去,高一学的。懒得记,看看

墙裂注意单位一致!
3课:化学反应速率
硬件:参加反应物质的结构。
软件:其他一堆条件,参考练习册前总结的知识点绝对找得到。(熟记该表格,高一和现在的选择题基本没问题)
1:若其他条件相同,升高温度,反应速率加快;降低温度,反应速率减慢。
2:催化剂可以改变化学反应速率,但是产量不能改变
3:有气体参加或溶液中发生的反应,增大浓度,化学反应速率加快,减少浓度,化学反应速率减慢。
4:对于纯固体或纯液体的反应物,改变他们的量不会改变化学反应速率。改变他们的表面积可以增加反应速率。
5:压强对化学反应速率的因素
i:恒温恒容,通入无关气体。浓度速率都不变
ii:恒温恒压(体积增大),通入无关气体。浓度减小,速率减小。
二级结论:催化剂改变活化能,但是▲H不变

在体积一定的容器内,如果想要加快反应速率。有两种方法
1:提高活化分子的百分数(一个瓶子有十个分子,其中有8个活化分子的反应速率一定比有2个活化分子快。)
2:活化分子百分数不变,但是增加了总的离子数。(还是那个瓶子,里面有100个分子,其中有80个活化分子,百分数没有变,同时体积也不变,在狭小的空间里更容易擦枪走火)
5节课:要来力!

当一个化学式已经判定为基元反应。反应速率方程
v正=k正.c(反应物)反应物化学计量数的次方.{c(反应物2)}.反应物2化学计量数的次方。(总之就是浓度的化学计量数的次方)
作为人教版的狗,平衡还没学。但是还是听一下。




4:影响化学平衡的因素与勒夏特列原理
(瞎逼逼:最近换季流感,垃圾俺直接高烧,上节课very重要。知识点还是要自己整理的好。)
化学平衡的移动:原来的→新的平衡。
化学平衡方向的判断
1:根据反应速率判断
1:条件 v正>v逆:向正反应方向移动
改变 v正=v逆:反应平衡,不移动
v正<v逆:向逆反应方向移动
2:Q与K Q<K,向正反应移动 (锤子定理 ) Q=K,不移动
Q>K:向逆反应移动
(这里的Q代表在任意一个时刻反应物浓度次方比上生成物浓度次方,K就是平衡后的比值)
3:勒夏特列:(我中彩票了,我可劲儿造。我花光积蓄买中国男足彩票,一毛没挣。出摊卖鸡屁股去赚钱)多了就减少,少了就变多。

出现必背方程式。👆
attention:要注意因果关系,通Hcl,导致H(aq)的浓度增大是因,个三根和冲个三根一个减小,一个增大是果。禁止套娃!如果把果当成因,再用勒夏特列原理,就会无限循环,夏日重现哒咩!
浓度:增大反应物浓度或减少生成物浓度→正反应方向移动
减少反应物浓度或增大生成物浓度→逆反应方向移动
压强:只要涉及压强的题目,1:压强只影响气体,2:如果涉及到压强对平衡的移动,赶紧看一下反应前后气体计量数总和有没有发生变化,3:加压,减压通过压缩or扩大容器体积来搞(通入气体来加减压就打咩),so物质浓度 都 会随着增大或者减少。

口诀:大压小移,小压大移
温度:

关于减弱:如何理解?比如王者里面,你买装备,买铭文到满级。但是在对战争中该死还得死。铭文和装备可以帮助你提高移速血量,但是不能改变你因菜送的事实。

6:化学 平衡
GN(概念):在一定条件下(等温等容或等温等压),对于同一个可逆反应体系,只是起始加入物质的情况不同(不同投料方式),但达到化学平衡时,同种物质的百分含量,(如 体积分数,物质的量分数或质量分数)均相同,这样的反应叫做化学 平衡。
A:化学平衡状态与条件有关,而与建立平衡的途径无关,一个 反应从不同的起始状态达到了相同的平衡状态。不同的起始状态是指各物质的起始量不同,而相同的平衡状态是指各物质的百分含量均相同。
状况1:恒温恒容下,反应前后气体分子数目改变的可逆反应
条件:如果按方程式的化学计量关系转化为方程同一半边的物质,其反应物(或生成物)物质的量与对应组分的起始加入量完全相同,则建立的化学平衡状态是等效的。(等量等效)
状况2:恒温恒容下,反应前后气体分子数不变的可逆反应
条件:反应物(或生成物)的n与起始加入量比例相同,就等效。
状况3:恒温恒压下的可逆反应
条件:反应物(或生成物)中各组成的物质的量比例相同,反应平衡。物质的量分数,体积分数,平均摩尔质量,密度,压强,反应速率均相等。但是气体的n和v不同,成比例。
化学反应的方向

外力(非自发):电解,光照
动力(自发):点燃,加热,高温,催化剂

混乱度:就是字面意思噻。
任何反应都有从有序(低乱度)→无序(高乱度)的趋势。

跟拉屎有关。吃下的东西中原子排列是有序的,屎拉出来里面的原子无序啦



哪边钉子尖尖就锤哪边咯,锤子的方向是反应可以自发进行的方向(锤子定理)(瞎编的
T≥0


7;kp计算
kp(用压强表示的平衡常数):压强×物质的量分数。
8.电离平衡常数(上节课必听)
1:在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的(已点离)各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数。

Ka表示酸(acid)的电离平衡常数
Kb表示碱的电离平衡常数
一些常见例子,记忆熟练写⬇

电离平衡常数的意义 表示弱电解质的电离能力
(强电解质没有,因为全都电离了,电离平衡常数相当于无穷大,没有表示的意义)
相同条件下,Ka越大,弱酸的酸性相对越强 ;Kb越大,弱碱的碱性相对越强;多元弱酸是分步电离的,每一级电离都有相应的电离平衡常数(用Ka1,Ka2啥的表示),且Ka1>>(远大于)Ka2>>Ka3,其酸性主要由第一步电离决定。
电离平衡常数的影响因素
内因:同一温度下,不同的弱电解质的电离常数不同,说明电离平衡常数首先由物质的本性所决定
外因:对于同一弱电解质,电离平衡常数只与温度有关,由于电离过程为吸热过程,所以电离平衡常数随温度升高而增大。
电离度及应用
定义:弱电解质在水中的电离达到平衡状态时,已电离的溶质的分子数占原有溶质分子总数(包括已点离和未电离的)百分率,称为电离度。用α表示。
意义:电离度实质上是一种平衡转化率,表示弱电解质在水中的电离程度。温度和浓度相同时,一元弱酸(注意只有酸)的α越大,Ka越大,酸性越强 。
影响因素:浓度大,电离度 减小(加水,反应正移,离子浓度增大)
越稀越电离
电离度与电离常数的关系

当你的题目中所求涉及的是弱酸(醋酸以下都算,H3PO4,H2SO3不行),可以用以上二级结论。强酸不可!!
溶液离子平衡
9.PH
定义:PH=-Lg(H*)(负对数)
意义:PH越大,碱性越强
PH越小,酸性越强
溶液的酸碱性判断
溶液的酸碱性取决于溶液中c(H)和c(OH)的相对大小
只有当常温(25)时,ph=7才是衡量溶液酸碱性的标准
要点:1:酸性(碱性)溶液不一定含酸或者碱。比如Na2CO3溶液显碱性,原因是碳酸根水解水,夺走了H*,结合生成OH根。显碱性
2:判断溶液的酸碱性不能根据C(H)和C(OH)的绝对大小,而应该比较相对大小,从而不受温度的影响
3:溶液的酸碱性不能根据ph判断,ph只是一个数据,代表溶液中H的-lg
4:当H或OH的浓度大于1mol/L时,直接用浓度表示。




强酸强碱中和滴定
这节课没有要怎样理解的,所以只截图,熟记。










中和滴定误差分析
原理:V标 是我们要测量的
C标 和 V待 是实验已知的。
C待是我们要求的
所以只要分析出不正确操作引起的V标的变化,即可分析出结果

由水电离出的氢离子变化图
解题不要复杂!中心思想就一招!
看是促进水的电离还是抑制水的电离
抑制:外加酸/外加碱/加NaHSO4(强电解质,可以分解出H+
促进:可水解的盐

最后一行的例子:同样都是PH=7但是由于CH3COOH是可水解的盐,所以促进了水的电离,所以后者水电离程度大。
至于奇怪为什么PH都=7但是水的电离程度不一样。这是因为醋酸铵还有一部分H+储存在醋酸中,而NaCl就没有捏。

没开始加盐酸时:溶液只有NH3.H2O
到达b点时:有NH3.H2O和NH4Cl,此时PH=7的原因是:NH3.H2O抑制水的电离,而NH4Cl促进水的电离。两者物质的量相等时,氨水电离出的OH-刚好被氯化铵给中和,所以溶液显中性。
到达c点时:NH3.H2O被Hcl完全中和,此时溶液全是NH4Cl(aq)
到达d点时:溶液里的NH3.H2O被完全中和,且Hcl过量,溶液中有NH4Cl和Hcl.分析与b点一样。

盐类水解
定义:盐电离出的离子与水电离出的H+或OH-互相作用生成弱电解质的反应。(去看视频(在开头),老师的比喻很形象)
特点:(1):可逆:水解是可逆反应,在一定条件下达到化学平衡。
(2):通常盐类水解程度很小,一般无沉淀析出,无气体放出(太少了就忽略了捏)
(3)盐类水解反应是酸碱中和反应的逆反应,为吸热反应,所以温度升高有利于水解。
盐类水解规律:有弱才水解,无弱不水解。
注意,只是正盐!!!!

正盐和酸式盐的区别:酸式盐含有氢离子,正盐不含氢氧根离子和氢离子。

越弱越水解:越难电离的酸(酸性越弱),电离之后的酸根对水的水解能力越强。

记忆方法:先记忆酸,酸性越强对应的碱性越弱 同时电离程度和酸挂钩, 水解程度和碱挂钩 ,PH值 和与氢离子结合能力也是和碱挂钩
口诀:酸离碱水

解释:当溶液中出现2个可以水解的 阴阳离子时 这时候阳离子会生成氢离子 阴离子会生成氢氧根离子。 氢离子和氢氧根离子 会结合生成水 这时候 由于 离子的缺失 反应就会正向移动 (勒夏特列)导致 这些离子完全水解 就叫做完全双水解 。
重点是记忆截图内容,要记啊啊
实在不行抄在纸上做题的时候对着看,然后考前突击背诵,其实刷题多了就考几个捏。
电解质溶液三大守恒(就是写等式内块儿)
电荷守恒的口诀:阳离子摆一边,阴离子摆一边,电荷数往前乘。
这三个的式子是一样的

2:物料守恒(元素守恒)
关键:找准变化前的核心元素之间的比例(别找H和O,要找溶质里面的元素。)
以及核心元素在水溶液中的所有存在形态。
Tips:先找核心元素,然后确定他们的比值关系,交叉相称,使彼此相等

溶液中微粒关系

题型1:n(物质的量)相同的混合溶液。
比较粒子浓度的大小。(A,C选项)
两种问法:
1:思路:因为n相同,体积,浓度都相同,所以溶液1:1混合。此时找出不会水解的粒子,该粒子(或者这些粒子)的c就是按照比例的。 再看其他的粒子,观察其是否水解,是否电离,还是两者都有。如果是两者都有,那么要考虑到底是那一种方式对该粒子的浓度影响更大,在这里记住,粒子对应的溶液显酸性,电离影响大。若显碱性,则水解影响大。(如果告诉你PH就更简单了)
2:判断质子守恒方程式是否正确(B选项)
思路:首先明确什么叫做质子守恒,意思就是酸碱失去的质子守恒,而不参与水解的粒子不会参与质子守恒,所以,质子守恒里没有不参与水解的粒子。以此作为判断是否为质子守恒的依据。 明确是质子守恒后就要知道,元素守恒(物料守恒)和电子守恒联立可以得到质子守恒,所以写电子守恒和元素守恒进行联立,消元(这里是遵从算数加减法的),最后看自己得到的与选项中的是否一致。
TIPS:n相同(就相当于c,v相同)的弱酸和弱酸盐混合溶液最后得到的质子守恒遵循下面的格式:c(弱酸)+2c(H+)=c(弱酸根)+2c(OH-)。(选择很好用就要记下来喔)
3:出现不属于三大守恒的等式
思路:啥也别管,一旦确定是这种特殊的等式,先写混合溶液的电荷守恒(阳一边,阴一边,电荷前乘)and元素守恒(水解的和不能水解的按比例交叉相乘)。再观察选项中给出的式子没有哪个离子。以这个为突破口,联立上面两个式子,消去该离子,得到的式子与选项式子进行比较(考试写不出来就算了,费时间,留到后面做)
捏吗肝不动了,睡了。
以下是草稿,不用看:
忽略次要因素,只关注主要因素。
比如混合溶液A和B,要分别看A和B是否可以水解或者电离,然后判断电离和水解哪个是主要因素。再上升到AB层面去比较谁多谁少。
如何判断一个式子是质子守恒:
式子中不存在和水解无关的粒子(比如cl)
如何判断一个式子是电荷守恒:
阳离子在一边,阴离子在一边
如何判断一个式子是物料守恒嘞:
看到中性就想到电荷守恒
越弱越水解:这个酸的酸性越弱,其对应的盐的碱性越强。

原电池!来啦!
原电池基本概念
1:能量转换:将化学能转化电能
2:原电池工作原理:氧化还原为中心,两级一液成回路
(1):负极:失电子,发生氧化反应(师傅)
(2)正极:得电子,发生还原反应
(3)电子由负极经过外电路流向正极(由负到正)
(4)离子移动:阳离子正极移动。阴离子负极移动(正正负负)

4:根据原电池的两电极材料来判断
两种金属(或者金属与非金属)组成的电极,若他们都与(或都不与)电解质溶液单独能反应,则较活泼的金属作负极;若只有一种电极与电解质溶液能反应,则能反应的电极做负极。
5根据电极现象来判断
工作后,电极质量减少,说明该电极金属溶解,失去电子变成金属离子,则该电子为负极;电极质量增加或者不变,说明溶液中的阳离子在该电极放电生成金属单质或者溶液中的阳离子得到电子,该电子为正极。


2:常见的化学电池
不咋考的就看书去
这个要记住
二次电池-铅酸蓄电池



选修2!!!!前面的亿些就不整了。直接摆了半年现在打算重新好好学习....(挠头
原子大酒店
能层:楼层(1.2.3.4....)
能级种类:房间不同种类(s型,p型,d型...)

原子轨道:不同楼层同一种类型的房间
原子轨道数:每一层的房间总数目(能层的平方)
电子云:是小倩学姐喔,根本就是鬼看不见。电子云是描述学姐(原子)出现概率的图.
s轨道:球形
p轨道:哑铃型(有三个生长方向,所以有三个房间嘞)
d轨道:花瓣形,5个
原子轨道能量高低:
前提:房间(轨道)越好,心情越好,能量越低。
s轨道:海景房
p轨道:商务间
d轨道:普通套房
f轨道:杂物间
1):相同能层上原子轨道的能量高低:ns<np<nd<nf
2):形状相同(同s,p,d...)的原子轨道能量的高低:1s<2s<3s<4s
3)同一能层(楼层)内形状相同而伸展方向不同的原子轨道的能量相等。npx=npy=npz
总结:对于每个n(楼层)值而言,有n种能级(房间类型),有n2个原子轨道(每一层的房间总数),最多有2n2个电子(每一楼层入住的客人的最多人数)
客人入住房间的顺序:

泡利不相容原理(夫妻住同一个房间)
洪特规则(女士优先)
电离性与电负性
主要讲:
原子半径大小决定因素:电子的能层数和核电荷数
核电荷数主要影响是同一周期同一层
Li他的原子半径要大于Al Si P S,所以第三周期的原子半径不全大于第二周期。
除此以外全都是会大于。
电离能
定义:气态电中性基态原子失去一个电子转化为气态基态正电子所需要的最低能量叫做元素的第一电离能。用I1表示。


1a族电离能最小,0族电离能最大

要会解释为什么:
因为Be价电子排布式是全满,不容易失电子,所以电离能要高。
试卷上写的:Be失去一个电子,需要破坏2S全满稳定结构,所需的电离能比较大.


由表格得到的电离能与化合价的规律


上面这个玩意给记住,要考的。
电负性
元素的原子在化合物中吸引键和电子能力的标度叫做电负性。
键和电子:原子之间产生化学作用力,形象的叫做化学键,用于形成化学键的电子叫做键和电子。
用氟的电负性4.0和锂的电负性1.0作为相对标准得出各元素的电负性。



元素周期表(万恶之源)
第八组不是副族,也不是主族
3B到2B是过度元素,全他吗都是金属,叫做过度金属!但是并不是只有这一部分的元素全是金属!
类金属:弟弟捧着神龟,在金属和非金属的交界处!
价电子和最外层电子:别搞错了我丢(恼)。要搞清楚这个,先画斜线图

这个价电子是什么嘞,叫做最外能级组,能级组又是什么嘞,叫做能量相近的原子轨道。怎么划分嘞,如图所示。

所以让你写价电子排布式就要这么整。
但是主族元素除外,只有过渡元素可以用。主族元素价电子和最外层电子一样。
最外层电子排布式是什么,横着来看。
要注意,铬和铜这两个不规律

每一个区都是有金属元素的喔
物质结构与性质:利用原子结构与元素性质推断前四周期
选秀二:晶体
物体的聚集状态与晶体的常识
物质的聚集状态:
1:许多的晶体中并无分子,比如氯化钠,石墨,二氧化硅,金刚石以及各种金属。都是连在一起的。
2:气态和液态物质不一定都是由分子构成。
等离子体(气体物质)和离子液体有的由离子构成。
等离子体:由电子,阳离子,电中性粒子(分子或原子)组成的整体上呈现 电中性 的 气态 物质。
离子液体:熔点不高的,仅由离子组成的液态物质。
3:其他物质聚集状态:晶态,非晶态,塑晶态,液晶态等。
晶体概念:内部微粒在三维空间内呈现周期性有序排列而构成的具有规则几何外形的固体
有离子晶体,分子晶体,原子晶体,金属晶体
非晶体概念:内部排列无序,不具有规则外形的固体

晶体的特点:
1:自范性:指在适宜的条件下自发的呈现封闭的,规则的几何多面体外形,称为晶体的自范性。
形成条件:晶体生长速率适当

水晶这个例子
外面是玛瑙,是冷却的快形成的
里面是慢慢冷却形成的水晶

2:各向异性:不同方向上的微粒排列情况不同。so,在不同方向上有不同的物理性质,比如导电性,导热性,硬度,理解性

区分晶体与非晶体最好的方法:X-射线衍生

获得晶体的途径
1:溶液析出
2:气态物质冷却不经过液态直接凝固
3:熔融态物质凝固

晶胞
概念:描述晶体结构的基本单元
2:晶胞与晶体的关系
一般来说,晶胞都是平行六面体。整块晶体可以看作是数量巨大的晶胞“无隙你吗打不出来”
无锡:代表没有缝隙
并指:代表晶胞平行排列取向相同。
所有晶胞的形状及内部的原子种类,个数及几何排列是完全相同的。
晶胞中 粒子数目的计算

配位数:指一个原子周围距离最小且等距的原子个数。

铜晶胞:有12个配位键!
铜晶胞是 面心立方最密堆积 ,这个模型很重要
萤石就是氟化钙

坐标!金刚石里面的原子呈现上下两层 一前一后,一后一前!

六方最密堆积:配位数12

分子晶体的概念
1:只含分子的晶体,或者分子间以分子间作用力结合。
分子间作用力表示范德华力或者氢键

这里要注意分子内原子间的力为共价键。但是不是所有的原子间都是共价键,稀有气体没有共价键但是收到分子间作用力也会形成分子晶体
只要是气体或者液体,除了Hg和离子液体以外都是分子晶体
离子晶体:

性质
1:熔沸点较高,难挥发。因为离子键强度较大,要使物质融化或沸腾,就需要较高的能量。
2:硬度较大,难于压缩。易于破碎,钻石虽然硬度大,但是容易碎。因为晶体受到冲击力作用时,部分离子键发生断裂。
3:不导电,但是在熔融态或者水溶液中可以导电。离子晶体里离子键较强,离子不能自由移动,即无自由移动的离子,但是熔化或者溶于水可以
4:大多数离子晶体极易溶于极性水溶液,难溶于有机溶剂。
如汽油,苯,四氯化碳等
遵循相似相溶规律

关键词:室温或者稍高于室温!
NaCl晶

CsCl晶胞

ZnS晶胞:和金刚石晶胞十分像。求S离子与Zn离子的最短距离,实际在求体对角线的四分之一。


过渡晶体:
纯粹的晶体是不多的,大多数晶体是他们之间的 过渡晶体。

离子晶体和共价晶体的过度标准是化学键中离子键成分的百分数。



石墨熔点大于金刚石熔点原因:由于石墨存在大Π键,所以破坏起来困难。
考点精华喔喔喔喔~还剩2节~
晶体密度的计算公式

要注意的是:若是nm直接21次方
若是pm直接30次方
研究有机化合物的一般方法:缺的课就是都记在笔记本上力,估计会在课程结束后传上来。这节课的笔记也记了一般,从实验式的测定步骤(李比希法)开始记起!

质谱图要点:看质核比最大的数值即为相对分子质量。
求出刚开始求得的实验式式量,与相对分子质量进行一个比,所的数值为n,可以球的分子式





苯与芳香烃
在烃类化合物中,有很多分子内含有一个或者多个苯环,这样的化合物属于芳香烃,苯是最简单的芳香烃
芳香族化合物:只要出现苯环
芳香烃:有苯环,只有C,H
苯的同系物:只含有一个苯环,符合通式CnH2n-6

要记住杰哥写的这几个对应物质,尤其蒽和萘
苯的物理性质
无色,有特殊气味,液体,有毒,不溶于水,易挥发(一定都记住)
沸点80.1,熔点5.5,密度0.88(小于水)
结论:液态的烃类都不溶于水,且密度比水小
是烃则轻!!
苯的分子结构(要学了必修2)
1:苯不存在碳碳双键,也不存在碳碳单键和碳碳双键交替出现的情况,也没有碳碳单键,但是有其他的单键(C-H)
2:苯分子的碳碳键是一种..就是大Π键和单键并在一起的东西(看图)

苯的化学性质
只能说背了就得分,建议天天背,叠着背,反复背。


醇
- 醇的分类

生活中常见的醇

醇的物理性质:醇会形成分子间氢键,提高沸点和溶点

c是拖油瓶,c越多越不溶于水

醇的化学性质
本质:O吸引电子的能力很强,导致C-O键和O-H键岌岌可危,所以醇的化学反应全都在这两个键上
- 与活泼单质的置换反应(反应在O-H键)(置换反应是四大基本反应之一)

无水乙醇!若有水会先与水反应
得到的结论:因为烷基有推电子的作用,所以导致O-H键的极性没有很强。所以反映不是很剧烈
2.取代反应(属于四大基本反应里的复分解,接下来学到的基本全是复分解反应里面的分支)(C-O键)
3.酯化反应(酸脱羟基醇脱氢)
验证方法:原子示踪法
坑:因为是可逆反应所以反应无法完全进行,所以失踪原子到处都有


消去反应((C-O)键,分子内氢键!)

硫酸酒精三比一,温度迅速170
浓硫酸脱水剂

杂质:挥发出的乙醇,浓硫酸炭化,碳和浓硫酸反应,产生So2,CO2(都可以让高锰酸钾褪色)
坑:1.NaOH用于除去挥发出的乙醇和so2,co2
消去反应:满足条件分子内一定邻位C原子上有H!才能发生
与卤代烃的消去反应做比较
醇和卤代烃可以发生消去反应

氧化反应
1.燃烧
2.乙醇的催化氧化※!特爱考
本质:先拔掉两个H,后拔掉一个H然后再接个OH。
醇——醛——羧酸
每次都失去两个电子
杰哥教用结构式判断化合价小方法:⬇


断了键1,3。

一个自我的小结:学习醇的化学性质,首先要明确,醇发生反应只能在C-O键和O-H键上。(除了燃烧蛤)
在此基础上,学了一个置换反应,是高一的,是O-H反应
然后学了取代反应,特点是都是发生在分子之间的(就是两个),而且醇永远断C-O
后又学了消去反应,热衷于单键变双键,掠夺分子内的H,O原子。这个反应发生在分子内部,而且一定满足的是OH碳邻位的碳一定要有氢,而且这里的实验坑要注意
后又学了氧化反应,而在这里,反应条件变成了分子内部与OH连的C一定要有H。同样也是掠夺原子
氧化的总结:
一个H变成酮

醇可以和高门酸碱and重铬酸钾反应蛤

这个相当的重要!

醇跟醚的同分异构(绝了)


