复古盘点:上个世纪那些风靡一时的“不老泉”为何如今悄无声息?

引言
人们对长寿的愿望就像是时间洪流中的一盏“长明灯”,引导着寻找“长寿仙丹”的脚步从不停歇,在中国古代的中药书里,“轻身不老”[1]的字样就是一台“造梦机”,妆点着从帝王到平民共同拥有的“长生梦”。
但是一直到上个世纪初,衰老学的概念才正式入驻科学领域[2]。“长寿”的强烈愿望的驱使下,抗衰药像雨后蘑菇一样纷纷“破土而出”,抗衰科研圈子里外,都涌现了一大批“当代神农”,为这些“不老泉”前仆后继。
有哪些长寿药在时间的奔流中被淹没沉底?在衰老学初具规模的今天,就让我们再来看看那些曾经红极一时的抗衰药,感受那个时代面对衰老学的科学热情。


首先走来的是那个年代的重量级“元老”选手:褪黑素。
褪黑素最早在1958年作为一种“美白因子”被发现[3],但一直到70年代,专门针对褪黑素的检测方法建立,才让人们真正发现它的功能和作用。
因为褪黑素在人体内的昼夜分泌量不同,所以昼夜节律调节作用就成为了褪黑素的第一个被发现的“生理功能”[4],自此开始就开启了属于它的 “褪黑素时代”。
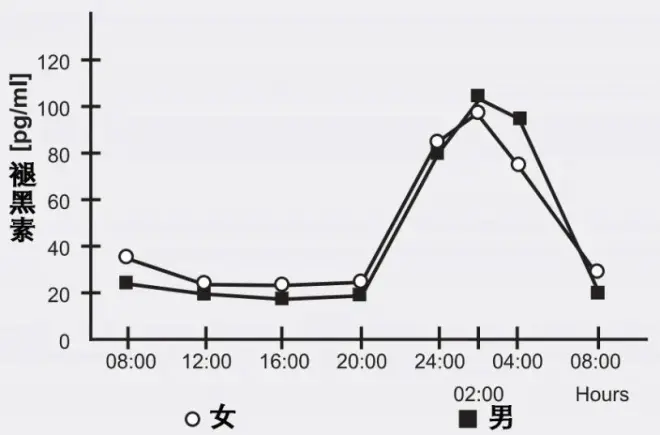
图注:褪黑素分泌的昼夜差异
到上个世纪90年代,褪黑素已经快速集齐了辅助睡眠、调整节律、辅助治疗癌症、心血管疾病等“成就”[5],并以“有效的抗氧化剂和自由基清除剂”的身份[6]作为敲门砖,正式向衰老进军。到20世纪末,全世界已有数百万人服用褪黑素,并认为它是最可能为人类谋求健康长寿的“灵丹妙药”。
又20多年过去,虽然对褪黑素的抗衰研究一直不断[7],甚至已经有它的2项临床试验[8],它作为失眠药的销量也极好,但它在“顶尖抗衰药”的行列里终究是越来越排不上号了。终其原因,还是因为它的抗衰效果不如那些“新药”(雷帕霉素、α-雌二醇等)显著,褪黑素能做到的“抗衰”它们也能做到,但是它们能做到的“延寿”褪黑素却无法实现。

如果要说有什么能和褪黑素并称“90年代抗衰双雄”的话,那么一定就是脱氢表雄酮了[2]。自上个世纪80年代起,DHEA的相关研究就已经走进了大家的视野。
首先让人们关注到它的其实是它在人体中的含量,它是人体中最丰富的神经类固醇激素,但是随着年龄的增加,DHEA却越来越少,到了晚年留给人们的只有年轻时的5%不到[9]。

图注:人体里的DHEA含量随着年龄的增长而快速下降
在这个数据的基础上,当时的人们又对DHEA进行了深入的研究,发现它和多种与年龄相关的衰老情况挂钩,尤其是有研究表示,它能起到保护神经的作用[10],于是,从90年代中期开始,DHEA就开始作为“青春之泉”药丸而被大量推广。
但是,DHEA如今也“40多岁”了,20年前人们对它的评价时是“生理功能尚不明朗”[11],到20年后的现在也还是“仍然是一个谜”,至今没能在它身上得出“可以有效抗衰/延寿”的结论[12]。
同为性相关类固醇激素的DHEA “同事”α-雌二醇如今都已成为美国抗衰顶级项目ITP的“座上宾”[13],而DHEA却“日渐落魄”。

烟酸“发迹”上世纪初一种源于NAD+缺乏的疾病“糙皮病”,患者皮肤皲裂、神志不清、形容可怕[14]。

图注:烟酸片和糙皮病
糙皮病的问题迫在眉睫,因此研究者们找到了NAD+的前体物质——烟酸,作为糙皮病“救星”。再加上NAD+在线粒体功能、表观遗传、修复DNA中的重要作用,烟酸也就顺理成章地成为了“抗衰新星”[15]。
兴奋的研究者们趁热打铁,接下去又发现烟酸能降低血脂、胆固醇[16],甚至还能抗炎[17],烟酸也因此在当时成为“红极一时”的心脏病药和潜在的神经疾病药。
但是研究着研究着就不那么对劲了,烟酸带来的副作用太大了哇!潮红、肝损伤、低血压、高血糖、致命性心律失常等[18],最后,多项研究数据的综合分析显示,额外补充烟酸反而会提高10%全因死亡率,至此烟酸延寿最后的希望也破灭了[19]。

图注:反而提高全因死亡率的烟酸
取而代之的则是它比较安全的“兄弟”——同为NAD+前体的NMN、NR,它们没有烟酸的这些副作用,但是有稳定的抗衰效果,甚至已经拥有了属于它们自己的“抗衰临床试验”,因此在“抗衰药”的道路上发展地越来越好。

生命两段分别是生长和衰老,在这个思路的启发下,对生长激素的抗衰研究也应运而生。1990年,一项关于生长激素的临床试验将生长激素推上了“神坛”,实验结果说,注射生长激素6个月,老年男性能年轻10-20岁[20]。

图注:该项临床试验的数据,简言之就是腰部酸腿不痛整个人都年轻态了
这项结果一出,就刮起了一股服用生长激素“抗衰”的热潮。
1996年8月,美国FDA批准生长激素作为药物上市,到1999年底,据统计美国已有数百万人在使用口服生长激素[21]。
但是,“前途一片大好”的生长激素很快就“翻车”了。首先是被发现有增加糖尿病的风险[22],更甚者,在多项模式生物实验和临床大数据调查中发现,生长激素以及它相关的关键通路GH/IGF-1和衰老的关系并不是单纯的正相关,反而更贴近于一种“U型关系”,也就是说太高和太低都会促进衰老和死亡[23]。

图注:敲除生长激素相关基因,小鼠反而能一定程度上延寿
至此,生长激素在抗衰市场上大伤元气,在抗衰药的队伍中也渐渐掉队。

“DHEA抗衰‘毫无根据’,白藜芦醇抗衰‘还在测试早期’”,2004年的一篇对比抗衰药的文章这样“疯狂拉踩”只为赞扬这一种抗衰药:“已测试成功”的司来吉兰(DEP) [24]。
这款药物最初被研发出来用于对抗抑郁症和老年痴呆,后来才在研究下慢慢偏向帕金森的治疗[25]。
早在90年代,DEP就被证明可以显著延长小鼠和狗等实验动物的寿命(例如能将老年犬的存活率从39%提高到80%)[26-27]。到2006年,这款药物延寿的原理被破解,除了能维持多巴胺水平以减缓大脑衰老,更是能激活经典长寿途径Nrf2,这等于是给DEP盖上了“学术金字戳”[28]。

图注:司来吉兰的干预下,狗的生存曲线被大幅延长
那为啥这款药物现在丝毫水花也没有了?首先的主要原因就是,这款药物太便宜了。
虽然这是处方药,但是通过兽医公司买的话,每片只要1.7美分(5mg),每天吃一片干预衰老,一个月只要半美元。1个月3块钱啊!这种没有赚头的“生意”,难怪会被“雪藏”(说不定胍胍研究不利也有这个原因呢)。
其次,在司来吉兰慢慢发展的同时,另一款药物则在迅速崛起——红酒分子白藜芦醇。白藜芦醇被证明也能保护大脑中产生多巴胺的细胞,并能通过激活长寿蛋白Sirtuins起到抗衰的作用,因此被大卫辛克莱等抗衰专家“力捧”,一时风头无两,落在司来吉兰身上的目光也就被分走了大半。
不过面向司来吉兰的抗衰研究至今仍在继续,说不定有一天,它能再次出现在大家生活里呢[29]。
时光派点评
上世纪只是消炎药的阿司匹林在当今却开始向抗衰出发,而很多那时的抗衰药在现在又偏安一隅专治一病。上个世纪的后半段既是生物医药大爆发的年代,也是一个不断试错的年代。抗衰药在其中的“精彩表现”自然也不能忽视。
包括但不仅限于上述的5款“抗衰”药物,在如今早已因为药效不好、安全性差等各种原因渐渐“沉默”,但是它们也曾如烈火烹油般辉煌过,被无数“长生追求者”奉为“神药”。
2007年的一篇文章中,现在大火的雷帕霉素、二甲双胍、白藜芦醇和CR模拟物已经成为当时预言家口中的“未来抗衰主力军”[30],但是说不定22世纪的人回头看我们,也要笑一句“哇,那个年代的人居然吃雷帕霉素和二甲双胍抗衰哎,不可思议”呢?
参考文献:
[1] 钟耀欣. (2018). 解读《神农本草经》. 开卷有益(求医问药).1:58-59. https://doi.org/10.3969/j.issn.1007-2950.2018.01.044
[2] Richardson A. (2021). You Have Come A Long Way Baby: Five Decades of Research on the Biology of Aging From the Perspective of a Researcher Studying Aging. The journals of gerontology. Series A, Biological sciences and medical sciences, 76(1), 57–63. https://doi.org/10.1093/gerona/glaa208
[3] Lerner, A. B. , Case, J. D. , Takahashi, Y. , Lee, T. H. , & Mori, W. . (1958). Isolation of melatonin, the pineal gland factor that lightens melanocytes1. Journal of the American Chemical Society, 80(10), 2587-2587
[4] Krieger, J. . (1997). Melatonin and the mammalian pineal gland, j arendt chapman and hall (1995), 331. Neurophysiologie Clinique/Clinical Neurophysiology, 27(4), 357-357.
[5] Karasek M. (1999). Melatonin in humans-where we are 40 years after its discovery. Neuro endocrinology letters, 20(3-4), 179–188
[6] Poeggeler, B., Reiter, R. J., Tan, D. X., Chen, L. D., & Manchester, L. C. (1993). Melatonin, hydroxyl radical-mediated oxidative damage, and aging: a hypothesis. Journal of pineal research, 14(4), 151–168. https://doi.org/10.1111/j.1600-079x.1993.tb00498.x
[7] Hardeland R. (2019). Aging, Melatonin, and the Pro- and Anti-Inflammatory Networks. International journal of molecular sciences, 20(5), 1223. https://doi.org/10.3390/ijms20051223
[8] https://clinicaltrials.gov/ct2/results?cond=aging&term=Melatonin&cntry=&state=&city=&dist=
[9] Guazzo, E. P., Kirkpatrick, P. J., Goodyer, I. M., Shiers, H. M., & Herbert, J. (1996). Cortisol, dehydroepiandrosterone (DHEA), and DHEA sulfate in the cerebrospinal fluid of man: relation to blood levels and the effects of age. The Journal of clinical endocrinology and metabolism, 81(11), 3951–3960. https://doi.org/10.1210/jcem.81.11.8923843
[10] Racchi, M., Balduzzi, C., & Corsini, E. (2003). Dehydroepiandrosterone (DHEA) and the aging brain: flipping a coin in the "fountain of youth". CNS drug reviews, 9(1), 21–40. https://doi.org/10.1111/j.1527-3458.2003.tb00242.x
[11] Johnson, M. D., Bebb, R. A., & Sirrs, S. M. (2002). Uses of DHEA in aging and other disease states. Ageing research reviews, 1(1), 29–41. https://doi.org/10.1016/s0047-6374(01)00369-4
[12] Schwartz A. G. (2022). Dehydroepiandrosterone, Cancer, and Aging. Aging and disease, 13(2), 423–432. https://doi.org/10.14336/AD.2021.0913
[13] Harrison, D. E., Strong, R., Reifsnyder, P., Kumar, N., Fernandez, E., Flurkey, K., Javors, M. A., Lopez-Cruzan, M., Macchiarini, F., Nelson, J. F., Markewych, A., Bitto, A., Sindler, A. L., Cortopassi, G., Kavanagh, K., Leng, L., Bucala, R., Rosenthal, N., Salmon, A., Stearns, T. M., … Miller, R. A. (2021). 17-a-estradiol late in life extends lifespan in aging UM-HET3 male mice; nicotinamide riboside and three other drugs do not affect lifespan in either sex. Aging cell, 20(5), e13328. https://doi.org/10.1111/acel.13328
[14] Public Health Reports, June 26, 1914. The etiology of pellagra. The significance of certain epidemiological observations with respect thereto. (1975). Public health reports (Washington, D.C. : 1974), 90(4), 373–375.
[15] Yang, Y., & Sauve, A. A. (2016). NAD(+) metabolism: Bioenergetics, signaling and manipulation for therapy. Biochimica et biophysica acta, 1864(12), 1787–1800. https://doi.org/10.1016/j.bbapap.2016.06.014
[16] Carlson L. A. (2005). Nicotinic acid: the broad-spectrum lipid drug. A 50th anniversary review. Journal of internal medicine, 258(2), 94–114. https://doi.org/10.1111/j.1365-2796.2005.01528.x
[17] Graff, E. C., Fang, H., Wanders, D., & Judd, R. L. (2016). Anti-inflammatory effects of the hydroxycarboxylic acid receptor 2. Metabolism: clinical and experimental, 65(2), 102–113. https://doi.org/10.1016/j.metabol.2015.10.001
[18] Hathcock J. N. (1997). Vitamins and minerals: efficacy and safety. The American journal of clinical nutrition, 66(2), 427–437. https://doi.org/10.1093/ajcn/66.2.427
[19] Jenkins, D., Spence, J. D., Giovannucci, E. L., Kim, Y. I., Josse, R. G., Vieth, R., Sahye-Pudaruth, S., Paquette, M., Patel, D., Blanco Mejia, S., Viguiliouk, E., Nishi, S. K., Kavanagh, M., Tsirakis, T., Kendall, C., Pichika, S. C., & Sievenpiper, J. L. (2021). Supplemental Vitamins and Minerals for Cardiovascular Disease Prevention and Treatment: JACC Focus Seminar. Journal of the American College of Cardiology, 77(4), 423–436. https://doi.org/10.1016/j.jacc.2020.09.619
[20] Rudman, D., Feller, A. G., Nagraj, H. S., Gergans, G. A., Lalitha, P. Y., Goldberg, A. F., Schlenker, R. A., Cohn, L., Rudman, I. W., & Mattson, D. E. (1990). Effects of human growth hormone in men over 60 years old. The New England journal of medicine, 323(1), 1–6. https://doi.org/10.1056/NEJM199007053230101
[21] Bayol, A., Bristow, A., Charton, E., Girard, M., & Jongen, P. (2004). Somatropin and its variants: structural characterization and methods of analysis. Pharmeuropa bio, 2004(1), 35–45.
[22] Liu, H., Bravata, D. M., Olkin, I., Nayak, S., Roberts, B., Garber, A. M., & Hoffman, A. R. (2007). Systematic review: the safety and efficacy of growth hormone in the healthy elderly. Annals of internal medicine, 146(2), 104–115. https://doi.org/10.7326/0003-4819-146-2-200701160-00005
[23] Junnila, R. K., List, E. O., Berryman, D. E., Murrey, J. W., & Kopchick, J. J. (2013). The GH/IGF-1 axis in ageing and longevity. Nature reviews. Endocrinology, 9(6), 366–376. https://doi.org/10.1038/nrendo.2013.67
[24] Flurkey, K., & Currer, J. M. (2004). Pitfalls of animal model systems in ageing research. Best practice & research. Clinical endocrinology & metabolism, 18(3), 407–421. https://doi.org/10.1016/j.beem.2004.02.001
[25] Miklya I. (2016). The significance of selegiline/(-)-deprenyl after 50 years in research and therapy (1965-2015). Molecular psychiatry, 21(11), 1499–1503. https://doi.org/10.1038/mp.2016.127
[26] Knoll, J., Dallo, J., & Yen, T. T. (1989). Striatal dopamine, sexual activity and lifespan. Longevity of rats treated with (-)deprenyl. Life sciences, 45(6), 525–531. https://doi.org/10.1016/0024-3205(89)90103-3
[27] Ruehl, W. W., Entriken, T. L., Muggenburg, B. A., Bruyette, D. S., Griffith, W. C., & Hahn, F. F. (1997). Treatment with L-deprenyl prolongs life in elderly dogs. Life sciences, 61(11), 1037–1044. https://doi.org/10.1016/s0024-3205(97)00611-5
[28] Nakaso, K., Nakamura, C., Sato, H., Imamura, K., Takeshima, T., & Nakashima, K. (2006). Novel cytoprotective mechanism of anti-parkinsonian drug deprenyl: PI3K and Nrf2-derived induction of antioxidative proteins. Biochemical and biophysical research communications, 339(3), 915–922. https://doi.org/10.1016/j.bbrc.2005.11.095
[29] Tábi, T., Vécsei, L., Youdim, M. B., Riederer, P., & Szökő, É. (2020). Selegiline: a molecule with innovative potential. Journal of neural transmission (Vienna, Austria : 1996), 127(5), 831–842. https://doi.org/10.1007/s00702-019-02082-0
[30] Blagosklonny M. V. (2007). An anti-aging drug today: from senescence-promoting genes to anti-aging pill. Drug discovery today, 12(5-6), 218–224. https://doi.org/10.1016/j.drudis.2007.01.004

