【有机化学基础】烃的衍生物-醇|零基础知识点讲解!

烃的衍生物-醇
醇的分类
1.根据醇分子中所含羟基的数目:一元醇、二元醇、多元醇

2.根据烃基所连烃基种类:

生活中常见的醇
1.甲醇(CH3OH) :无色、具有挥发性的液体,易溶于水,沸点为65°C。甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,
也可作为车用燃料。
2.乙二醇、丙三醇都是无色、粘稠、有甜味的液体,都易溶于水和乙醇,是重要的化工原料。
(1)乙二醇是汽车发动机防冻液的主要化学成分,也是合成涤纶等高分子化合物的主要原料。
(2)丙三醇具有很强的吸水能力,可用于制造日用化妆品。
醇的物理性质
1.沸点
(1)饱和一元醇的熔沸点随分子中碳原子数的递增而逐渐增大。
(2)相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。(氢键的影响)
(3)碳原子数相同时,羟基个数越多,醇的沸点越高
- 例题

2.溶解性:
醇在水中的溶解度一般随分子中碳原子数的增加而降低。
羟基越多,溶解度越大。
(甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以任意比例混溶。)
3.密度:醇的密度比水的密度小。
醇的化学性质
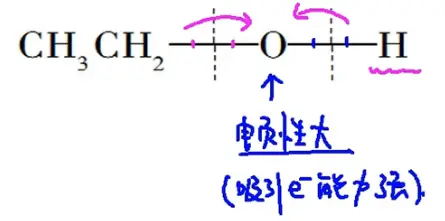
醇的化学性质主要由羟基官能团所决定。在醇分子中,由于氧原子吸弓|电子的能力比氢原子和碳原子的强,使O—H和C—O的电子 都向氧原子偏移。
因此,醇在发生反应时,O—H容易断裂, 使羟基中的氢原子被取代,同样,C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
醇的化学性质-与活泼金属单质的置换反应
1.乙醇与金属钠的反应:

2.钠沉于无水乙醇的底部,表面有气泡产生,慢慢消失;放出的气体可在空气中安静地燃烧,火焰呈淡蓝色;烧杯壁上有水珠生成;澄清石灰水未变浑浊
3.乙醇羟基的H原子活泼性较水的弱(醇分子中的烷基具有推电子作用)
4.其它活泼金属如钾、钙等也可与乙醇反应产生H2
5.产物乙醇钠在水中强烈水解:

醇的化学性质-取代反应
1.醇与浓的氢卤酸(HCl、 HBr、 HI) 发生反应时,分子的碳氧键发生断裂,羟基被卤素原子取代,生成相应的卤代烃和水。

2.酯化反应(酸脱羟基醇脱氢)

3.醇分子间脱水成醚:如果把乙醇与浓硫酸的混合物的温度控制在140°C左右,每两个乙醇分子间会脱去一个水分子而生成乙醚。

乙醚是一种无色、易挥发的液体,有特殊气味,有麻醉作用,易溶于有机溶剂。
像乙醚这样由两个烃基通过一个氧原子连接起来的化合物叫做醚,醚的结构可用R—0—R'来表示,R和R'都是烃基,可以相同,也可不同。醚类物质在化工生产中被广泛用作溶剂,有的醚可被用作麻醉剂。
醇的化学性质-消去反应
1.将浓硫酸与乙醇按体积比3:1混合,即将15 mL浓硫酸缓缓加入到盛有5 mL95%乙醇的烧杯中混合均匀,冷却后再倒入长颈圆底烧瓶中,并加入碎瓷片防止暴沸
2.加热混合溶液,迅速升温到170 °C,将生成的气体先通入NaOH溶液除去杂质,再分别通入KMnO4酸性溶液和溴的四氯化碳溶液中,观察现象。
实验现象:
产生了气体,该气体使酸性高锰酸钾溶液褪色,使溴的四氯化碳溶液褪色,烧瓶内有黑色固体生成。

乙醇在浓硫酸的作用下,加热到170 °C时生成乙烯:

醇类能发生消去反应的条件:临位C原子上有H

醇的化学性质-氧化反应
1.乙醇的燃烧:火焰呈淡蓝色,放出大量的热

2.乙醇的催化氧化

- 醇的催化氧化

条件:与-OH相连的碳必须有H,才能发生催化氧化反应
氧化反应:有机物分子中失去氢原子或加入氧原子的反应(去H加O)
还原反应:有机物分子中加入氢原子或失去氧原子的反应(加H去O)
- 氢原子数

3.醇与酸性重铬酸钾:
乙醇能被酸性重铬酸钾溶液氧化,其氧化过程可分为两个阶段:

交警利用乙醇能使橙色的酸性重铬酸钾变绿,检查司机是否酒后驾驶
乙醇的反应与断键位置总结

醇的同分异构体
饱和一元醇的通式为CnH2n+1OH,分子式满足CnH2n+2O的有机物,可能是醇,也可能是醚,在醇/醚里再分别考虑碳链异构、官能团位置异构。


