高一化学必修一知识点+课后练习(氯气的性质)

一、氯气的物理性质

【答案】黄绿色;大
二、氯的原子结构与存在
1. Cl原子结构示意图为________,容易______1个电子而形成Cl-,表现出较强的__________。
2. 氯在自然界中均以_______态存在。
【答案】

得到 氧化性 化合
三、氯气的化学性质
1.与金属单质的反应:Cl2能与绝大多数金属反应,且将其氧化到最高价。

2.与非金属单质的反应

【答案】安静地燃烧 苍白色 白雾
四、氯气与水的反应
1. 反应原理:___________________________________。
2. HClO的性质
(1)弱酸性:___________________________________。
(2)不稳定性:_________________________________(氯水需现用现配,保存在___色___口瓶中)
(3)强氧化性:次氯酸具有强氧化性,可用于自来水的杀菌、消毒,还可以用作______剂。
【答案】Cl2 + H2OHCl + HClO
HClOH++ClO-2HClO光照=====2HCl+O2↑ 棕 细 漂白
实验探究——氯气的漂白实验

资料卡片——次氯酸的漂白作用
HClO可以将有色物质氧化为稳定的无色物质,故体现出漂白性。被HClO漂白的物质,久置后不再恢复原来的颜色,即次氯酸的漂白过程不可逆。
3. 氯水的成分和性质
(1)反应原理:Cl2 + H2O HCl + HClO、HClOH++ClO- H2OH++OH-
(2)新制氯水中所含的微粒:________________________________________________
(3)新制氯水的性质及原因
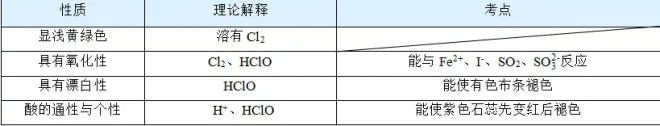
(4)久置氯水中所含的主要微粒为_______________,氯水久置,溶液酸性______,pH______。
【答案】(三分)Cl2、H2O、HClO、(四离)Cl-、H+、ClO-、OH-
H2O、Cl-、H+、OH- 增强 降低
五、氯气与碱的反应
1.与氢氧化钠溶液反应——制取漂白液
(1)化学方程式:____________________________________________________。
(2)离子方程式:____________________________________________________。
(3)漂白液的主要成分是_________________,有效成分是_________________。
2.与石灰乳反应——制取漂白粉/漂白精
(1)化学方程式:____________________________________________________。
(2)离子方程式:____________________________________________________。
(3)漂白粉的主要成分是_________________,有效成分是_________________。
【答案】1.Cl2+2NaOH===NaCl+NaClO+H2O;
Cl2+2OH-===Cl-+ClO-+H2O;
NaClO、NaClNaClO
2.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
2Cl2+2Ca(OH)2===2Ca2++2Cl-+2ClO-+2H2O;
Ca(ClO)2、CaCl2;Ca(ClO)2
对点训练
题型一:氯气的物理性质
【例1】(2021·全国)生活中可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的哪些性质
①密度比空气大②易液化③能溶于水④有毒
A.①② B.③④ C.④ D.①④
【答案】D
【详解】
氯气对动物具有毒性,能致死;氯气的密度比空气大,沉在空气底部;用氯气灌洞使氯气沉在洞底,洞内田鼠吸入后中毒而亡;
故选D。
题型二:氯气与金属/非金属单质的反应
【例2】(2021·全国高一课时练习)下列关于氯气的叙述正确的是
A.燃烧不一定有氧气参加
B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.H2在Cl2中安静燃烧,产生苍白色火焰,形成白色烟雾
D.通常状况下氯气能和Fe反应,氯气的储存不能用铁质容器
【答案】A
【详解】
A.燃烧是剧烈的发光发热的氧化反应,不一定有氧气参加,比如氢气在氯气中燃烧,故A正确;
B.CuCl2为固体小颗粒,产生棕黄色的烟,没有雾,故B错误;
C.生成的HCl极易溶于水,与空气中的水蒸气形成盐酸小液滴,是白色的雾,故C错误;
D.铁和氯气在点燃的条件下发生反应,常温条件下不反应,故常温下可以用钢瓶来储存氯气,故D错误。
故选A。
题型三:氯气与常见的还原性物质的反应
【例3】(2020·鲁甸县第二中学高一期末)把氯气通入下列各物质的溶液中,阴离子和阳离子都能被氧化的是
A.NaOH B.Na2SO3 C.FeBr2 D.FeSO4
【答案】C
【分析】
氯气具有强氧化性,把氯气通入溶液中,阴离子和阳离子都能被氧化,说明阴离子和阳离子都具有还原性,可被氧化。
【详解】
A.氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,只有Cl元素化合价发生变化,故A错误;
B.钠离子不能被氧化,故B错误;
C.Fe2+和Br-都具有还原性,可被氯气氧化,通入足量氯气和生成氯化铁和溴,故C正确;
D.SO42-不能被氧化,故D错误,
故选C。
题型四:氯水的性质
【例4】(双选)(2019·江苏盐城市·高一期中)某校化学兴趣小组在探究新制饱和氯水成分的实验中,根据实验现象推测的有关结论中错误的是
A.向氯水中滴入紫色石蕊溶液看到其先变红后褪色,推测氯水中含有Cl2分子
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,推测氯水中可能含有Cl-
C.向氯水中加入碳酸钠粉末,有气泡产生,推测氯水中含有H+
D.氯水放置一周后pH将变大,说明氯水中含有ClO-
【答案】AD
【分析】
氯气溶于水得到的溶液为氯水,氯水中,氯气大部分以分子形式存在,少量氯气与水反应生成氯化氢和次氯酸,氯化氢为强电解质完全电离生成氢离子和氯离子,次氯酸为弱电解质部分电离,据此分析解答。
【详解】
A.氯水中含有盐酸和次氯酸,向氯水中滴入紫色石蕊溶液看到,溶液变红,次氯酸具有漂白性,然后溶液又褪色,不能证明氯水中含有Cl2分子,故A错误;
B.氯气与水反应生成氯化氢和次氯酸,氯化氢为强电解质完全电离生成氢离子和氯离子,氯离子与银离子反应生成氯化银沉淀,故B正确;
C.向氯水中加入Na2CO3粉末,有气泡产生,是因为碳酸根离子与氯水中的氢离子发生反应生成水和二氧化碳,故C正确;
D.次氯酸不稳定,2HClO 2HCl+O2↑,氯水放置一周后,溶液中的盐酸浓度增大,pH减小,故D错误;
故选AD。
题型五:“氯”的漂白性
【例5】(2021·云南文山壮族苗族自治州·砚山县第三高级中学高一期中)下列说法正确的是( )
A.向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色
B.光照新制氯水有气体逸出
C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存
D.氯气有漂白性,所以氯气能使湿润的有色布条褪色
【答案】B
【详解】
A.久置的氯水成分为盐酸,向久置的氯水中滴入紫色石蕊试液,溶液将先变红不褪色,故A错误;
B.光照次氯酸分解生成氧气,所以光照新制氯水有气体逸出,该气体是氧气,故B正确;
C.漂白粉的主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,放久会与空气中的二氧化碳发生反应生成次氯酸而失效,应密封保存,故C错误;
D.氯气不有漂白性,具有漂白性的是氯气与水反应生成的次氯酸,所以氯气能使湿润的有色布条褪色,故D错误;
答案选B。
【点睛】
熟悉氯气的性质,氯水的成分是解题关键。

