“长胖了”就得衰老?细胞不可承受之重,原来检测衰老用肉眼就行

在一个平静的日子,一个细胞做出了一个重大的决定——衰老!
或是因为兢兢业业工作(复制)了太长时间,又或是受到了外界的伤害,又或只是受到旁边衰老细胞的影响……这个细胞开始涨大,开始表达β-半乳糖苷酶(SA-β-gal),开始分泌衰老相关分泌表型(SASP),然后悄无声息地崩溃、瓦解。
谁也不知道这个细胞默默走完了自己的一生。但是!一叶落而知天下秋,一细胞而知衰老至,每个细胞的衰老都值得被“铭记”!最近一篇发表在高质量Cell子刊上的论文,记载了细胞从体积变大到完全衰老的过程[1]。


对一个正常体细胞来说,自从诞生并成为一个成熟的细胞,胞生就开始重复一个名为“细胞周期”的循环。它们从细胞分裂中诞生,很快又投入到细胞分裂的事业中,正是源源不断的细胞分裂,造就了多达几十亿细胞的“人体帝国”。
细胞周期分为4个周期:G1期、S期、G2期和M期。
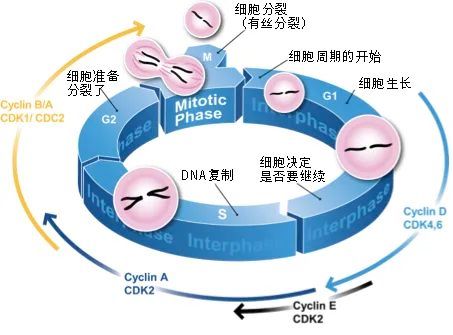
图注:细胞周期及其在每个时期需要的周期蛋白
G1期是一个细胞周期的开端,在这里,细胞生长、收集各种生物质,为后面3个期做好充足的准备,只有具备足够的营养、氧气和能量,细胞才会进入下一期;
在S期,细胞复制DNA,产生细胞核内所有遗传物质的两个相同副本,在这个步骤如果监测到DNA复制错误,细胞周期就会停止;
G2期是细胞生长和分裂准备的时期,细胞通过合成必需蛋白质来为有丝分裂做好准备,在G2期,细胞会再次检查DNA复制完整性及可能存在的错误;
最后在M期,细胞通过有丝分裂过程分裂成两个相同的细胞[2]。
至此,一个细胞周期就有惊无险地完成了。但是站在M期和G1期交界处的细胞不一定立即进入下一个细胞周期,当条件不适合,细胞会进入G0期等待一段时间,合适了再重新“开业”,但如果条件再也不合适了呢?

一个细胞是因为条件不合适“待业”了,还是永久“失业”了,人们一直试图搞清楚这两者之间的区别。
于是,他们提出了一些细胞衰老标志物:β-半乳糖苷酶活性、组蛋白H2A.X丝氨酸磷酸化(γH2A.X)以及具有异染色质蛋白1γ(HP-1γ蛋白)的衰老相关异染色质灶(SAHF)等[3]。
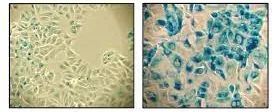
图注:常用β-半乳糖苷酶染色来显示衰老细胞(图中蓝色)
但是这些并不保险。就以最早也是最常用的体外检测衰老细胞的检测方法——β-半乳糖苷酶活性测定来说,虽然是一种简单检测方法,但β-半乳糖苷酶并非是衰老细胞的专利,非衰老细胞如LUAN巢A细胞等也过度表达β-半乳糖苷酶[4]。
在上个世纪60年代,一种看似离谱但慢慢被证明相当科学的辨别指标被引入衰老生物学——细胞尺寸[5]。同种细胞相貌相似,但是年轻的细胞千篇一律,衰老的细胞一目了然!
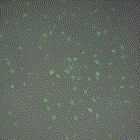

图注:小个儿细胞分裂无阻(上,绿色),大个儿细胞迈入衰老(下,红色)
研究者们用药物控制细胞尺寸,发现几乎所有尺寸大小正常的细胞都能顺利进入细胞周期,但约30%的大号细胞周期停滞,永远停留在了G1期。细胞周期是一个细胞“青春活力”的基本标志,无法进入细胞周期就代表其已不再年轻。
而且,即使是勉强恢复了细胞周期的剩下70%大细胞,也存在分裂时间更长、有丝分裂异常频率高等情况,它们产生出来的畸形细胞有的有核碎片,有的有双核,奇形怪状,不一而足。
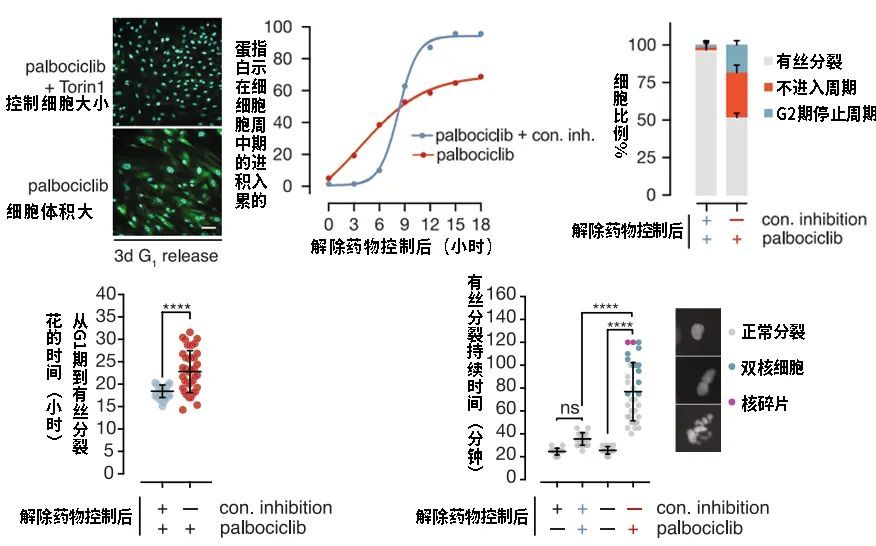
图注:体积大的细胞与正常细胞相比,有进入细胞周期少、细胞周期长、容易出现分裂出错等现象
为什么尺寸一大,细胞就老?研究者们去探索了不同尺寸细胞里的基因表达情况,发现了和小尺寸细胞不同、在大细胞中高表达的蛋白:p21和p53。p21是细胞周期蛋白CDK的抑制剂,而p53决定了p21的上调。
p21和p53的人为降低的确能让细胞恢复到原来小巧的模样,并恢复正常的细胞分裂周期,但是在大细胞时期留下的分裂异常的毛病却没能得到改善。为什么?难道p21和p53也不是大细胞衰老的根本原因?
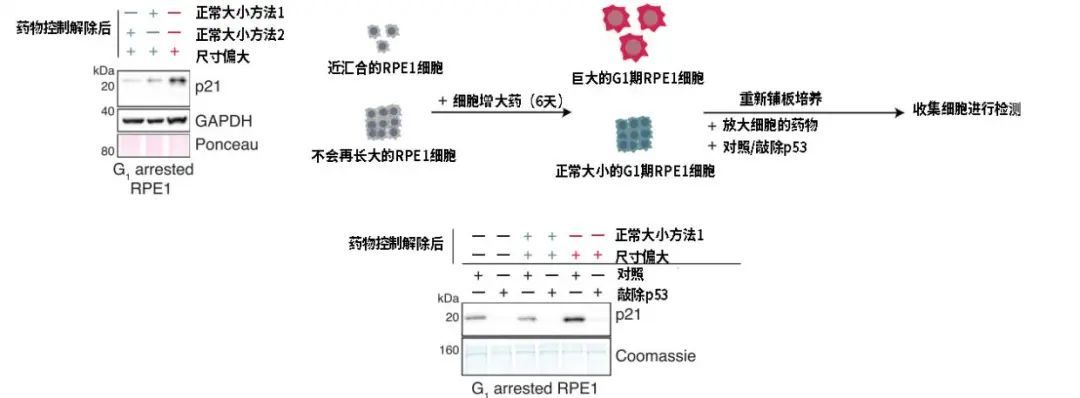
图注:大体积细胞中的p21表达猛增,且与p53的表达有关
研究者们继续深挖大细胞和小细胞之间的区别。药物控制会对所有细胞都产生复制压力,并造成DNA损伤,但是他们在同样重新进入到细胞周期的大细胞中发现了更多的DNA损伤积累。
这种基因组不稳定性的产生不仅仅是因为衰老细胞对一些基因毒性损伤更敏感,还因为这些DNA损伤修复途径被限制了。
外源伤害其实很容易在体细胞DNA(至关重要的遗传物质)上产生双链断裂(DSB)损伤,但是细胞总会在进入更关键的S期前做好准备。G1期的非同源末端连接(NHEJ)反应能修补好这些断裂处,让DNA损伤能得到缓解,不影响后续细胞周期。
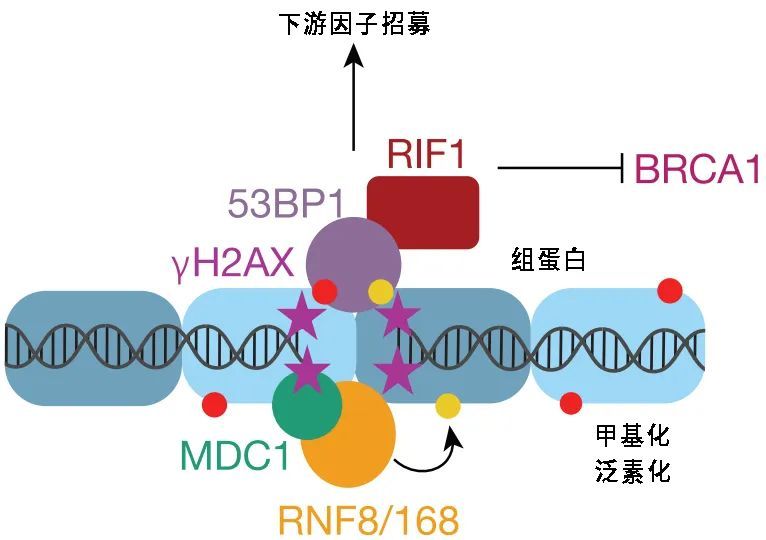
图注:NHEJ过程概述
G1期很短,NHEJ反应却并不简单,需要多个因子配合,形成53BP1灶,才能顺利完成修复。大细胞的问题就在这个环节中的一个小细节:RIF1。RIF1的缺失导致53BP1灶无法形成,NHEJ无法开展,DNA损伤无法修复。
一方面损伤增多一方面修复受阻,为什么细胞尺寸能指向细胞衰老状况已经清清楚楚,“胖”还真是细胞衰老的原罪。
细胞在工作中慢慢积累DNA损伤,作为DNA复制前的准备期和检查期,细胞势必要在G1期停留更长时间,也就积累了更多的其他生物质造成体积累增,但是体积增大后DNA修复能力又下降,久而久之恶性循环,细胞最终走向衰老、凋亡。
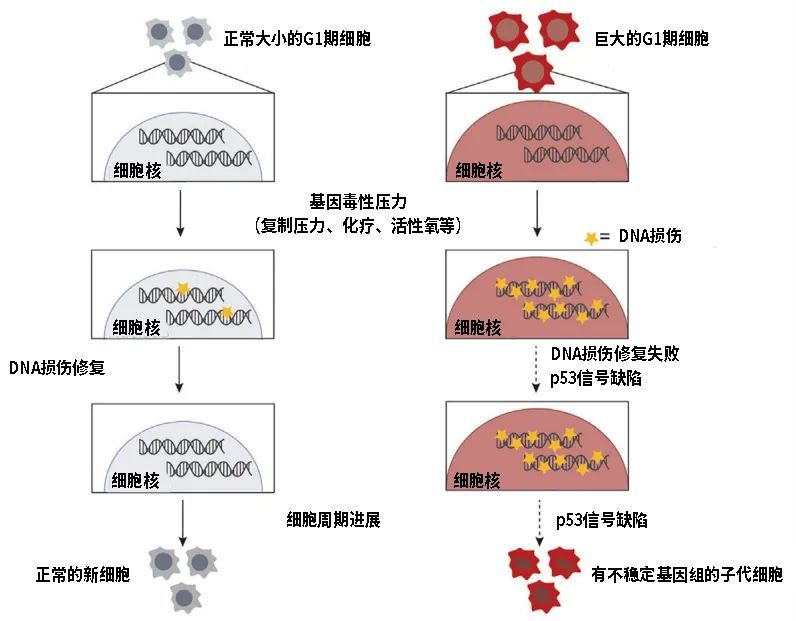
图注:细胞体积偏大导致细胞衰老的全过程

以为这就结束了?一般细胞一旦迈入衰老的行列,的确就如开弓没有回头箭,要么凋亡,要么保持衰老状态僵持!也就是所谓的“永久性”。
但是有研究发现,总有些衰老细胞不甘走到尽头,于是它们选择“衰老逃避”。在某些条件下,它们能恢复增殖,其中积累的衰老相关物质脂褐素也从细胞质中消失,看上去就好像正常年轻细胞一模一样。
如果只是短暂的衰老,那重回青春也没什么大不了,但如果在衰老逃避之前这些细胞经历了一段漫长的衰老期,再次年轻后就会与衰老前的状态相比发生巨大变化。
基因组、转录组和代谢水平均发生显著改变,在这个过程中,衰老细胞往往会因为基因组的改变而获得侵袭性、干细胞性和耐药性,俗称,A变了[6]。
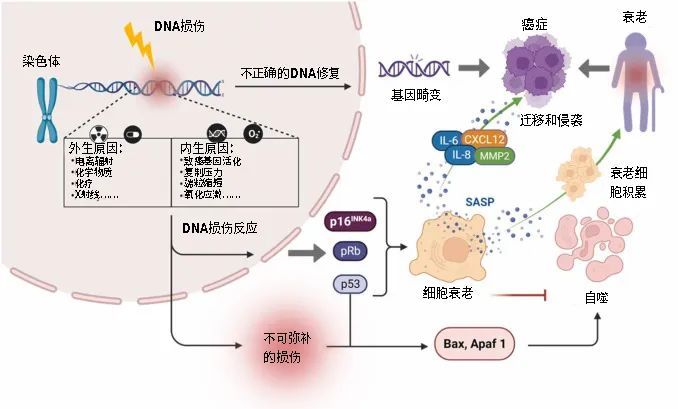
图注:细胞DNA损伤后的两条“出路”
和本文提出的细胞衰老特征相契合的是,体积大的细胞更可能衰老,大细胞的普遍问题是无法修复积累的DNA损伤,而DNA损伤不仅是衰老的原因,也是A变的根源。这些大细胞有的直接退出细胞周期走向衰老和S亡,另一些则坚持细胞周期,逃避衰老,走向A变。
这么一想,是不是还是衰老凋亡的结局更好?
———///———
细胞衰老是衰老的重要标志,而衰老是一个多方面且复杂的过程,细胞衰老中的DNA损伤作用就像是与其他细胞连锁反应(如蛋白质稳态和表观遗传学改变)的齿轮,导致与年龄相关的功能衰退[7]。
但是细胞衰老也并非全然是坏事,除了能阻止细胞A变,一些细胞的衰老还在伤口愈合、肝纤维化的减弱、皮肤疤痕和口腔纤维化的减少、肾纤维化的减轻以及动脉粥样硬化的预防等中发挥重要的作用[3]。
看清一个普通体细胞的一生,看到它们在个体的生长和衰老中虽然渺小但也产生的各种影响,是否会对你的衰老观念产生影响呢?
—— TIMEPIE ——
这里是只做最硬核续命学研究的TIMEPIE,专注“长寿科技”科普。日以继夜翻阅文献撰稿只为给你带来最新、最全前沿抗衰资讯,欢迎评论区留下你的观点和疑惑;日更动力源自你的关注与分享,抗衰路上与你并肩同行!



