Cell Reports | 炎症性疾病潜在靶点新发现
自然杀伤 (NK) 细胞是先天免疫系统中的效应淋巴细胞,主要通过产生IFN-γ对抗肿瘤和入侵的病原体。IFN-γ是一种在先天性免疫和获得性免疫中发挥着重要作用的细胞因子,参与组织内稳态、免疫监视和对炎症反应的调节。现有研究认为较高水平IFN-γ与炎症性疾病的发生有关。例如,IFN-γ在COVID19患者中通常是上调的,并在细胞因子风暴中起着重要作用。因此,人们认为IFN-γ的产生在体内受到严格的调控。近年来,研究显示粒细胞集落刺激因子(G-CSF)可抑制NK细胞分泌IFN-γ,但其背后的机制仍不清楚。
2022年9月13日,北京大学黄晓军教授和李程研究员作为共同通讯作者在《Cell Reports》(IF=9.995)杂志上发表了题为《In vivo G-CSF treatment activates the GR-SOCS1 axis to suppress IFN-γ secretion by natural killer cells》的研究论文,本研究阐明了G-CSF抑制NK细胞分泌IFN-γ的潜在机制,为炎症性疾病的干预和治疗提供了新的潜在靶点。值得注意的是,本研究中作者使用了汉恒生物提供的Crispr/Cas9慢病毒载体成功实现了对NK92细胞中SOCS1基因的稳定敲除。
接下来,我们一起看下本文的主要研究结果:
作者和其他团队先前的研究已报道,G-CSF可抑制骨髓和外周血中NK细胞分泌IFN-γ,而本研究作者对此做了深入探讨,以揭示G-CSF抑制NK细胞分泌IFN-γ的机制。首先,对受试者连续给与G-CSF处理5天,收集处理前和处理后第4天的骨髓NK细胞,进行RNA-seq、差异表达分析(DEA)和GO富集分析。结果显示,相比于G-CSF处理前,G-CSF处理后的骨髓NK细胞中IFN-γ的表达水平明显减少。这一结果与之前的研究结果一致。同时,还发现骨髓NK细胞发育、成熟和增殖的相关标志物显著增加,且NK细胞的凋亡受到抑制。这些结果表明G-CSF处理后改变了供体骨髓NK细胞的表型和功能。
此外,DEA结果显示,G-CSF处理后骨髓NK细胞中SOCS1上调最为显著。此前有研究发现SOCS1对小鼠体内IFN-γ的分泌具有负调控作用[1]。[A1] 为了研究SOCS1对人源细胞IFN-γ的分泌是否也有类似的调控作用,作者构建SOCS1过表达慢病毒载体和Crispr/Cas9慢病毒载体,分别建立了SOCS1过表达和SOCS1敲除的NK92细胞系。结果发现,过表达SOCS1能显著减少NK92细胞IFN-γ的表达;当敲除SOCS1后,即使用G-CSF处理,IFN-γ的表达仍然会增加。上述结果表明,G-CSF处理后NK细胞分泌IFN-γ的能力减弱与SOCS1表达增加有关。

图1 G-CSF处理导致IFN-γ分泌减少和SOCS1表达上调
接着,作者为了揭示G-CSF处理后SOCS1表达上调的具体机制,对之前G-CSF处理前、后的骨髓NK细胞进行ATAC-seq检测,结合RNA-seq的数据,使用DESeq2进行了DEA和差异可及性分析。结果确定了147个差异表达基因(DEGs)和335个差异可及区(DARs)。DEGs有上调和下调的,而所有的DARs在G-CSF处理后都表现出更好的染色质可及性,且位于这些区域的大多数基因表达增加。作者将在DEGs和DARs富集的前十个转录因子(TFs)构建了一个TFs-基因网络,发现可编码糖皮质激素受体(GR)的NR3C1是这一网络中的中心转录因子。而GR与糖皮质激素(GC)结合后,GR可转移到细胞核中并与人类基因组的数千个位置结合。有研究报道,G-CSF介导的造血干细胞动员与GC信号有关。因此,作者推测G-CSF处理激活了GC信号,进而影响NK细胞的功能。
为了验证这一假设,将两组骨髓NK细胞进行GR CUT&Tag实验,随着可获得性增加,DARs也显示出更多的GR结合信号,表明G-CSF处理后GR被激活并影响NK细胞的基因表达。有趣的是,GR靶基因FKBP5中转录起始位点前后有两个区域的可及性增加,且正好是GR的结合位点,在经G-CSF处理后显示GR结合信号增强。与FKBP5类似,作者发现在G-CSF处理后,SOCS1[A2] [h3] 附近的三个DARs也显示出了GR结合信号的增加,表明SOCS1表达上调可能受GR的调控。由此证实GR可被G-CSF激活,并直接调控SOCS1的表达。

图2 G-CSF诱导染色质整体可及性和基因表达改变
随后,作者检测了受试者在经G-CSF处理前、后血浆中皮质醇和ACTH的水平,发现二者的水平并没有显著的变化,即G-CSF处理后GR的激活与GC丰度的增加无关。而流式细胞术和RT-qPCR结果显示,G-CSF处理显著上调了NK92细胞和NK细胞中GR的mRNA和蛋白表达。进一步研究表明,G-CSF处理的NK细胞中两个参与GRs磷酸化的蛋白GSK-3b和JNK水平增加,促进GR的Ser211和Ser226位点的磷酸化,从而激活GR。这些结果说明G-CSF可促进GR转录,并通过磷酸化信号转导途径激活GR。

图3 G-CSF激活GRs并促进其转录
为确定GR的激活是否促进了SOCS1的转录,从而抑制NK细胞中IFN-γ的分泌,作者用地塞米松和G-CSF处理NK92细胞,发现二者均增加了NK92细胞中SOCS1的转录丰度,而加入GR拮抗剂RU486后显著逆转了二者的影响,表明GR的激活与G-CSF处理后SOCS1的表达上调有关。与受试者处理相似,获取小鼠骨髓NK细胞进行实验验证。结果与人类NK细胞一致,G-CSF处理明显增加了小鼠骨髓NK细胞中GR蛋白、NR3C1、GR靶基因的转录丰度;同时上调了SOCS1的表达、减少了IFN-γ的分泌,而RU486显著逆转了G-CSF的作用。以上结果表明,经G-CSF处理后,GR的激活上调了NK细胞中SOCS1的表达,并抑制其产生IFN-γ。
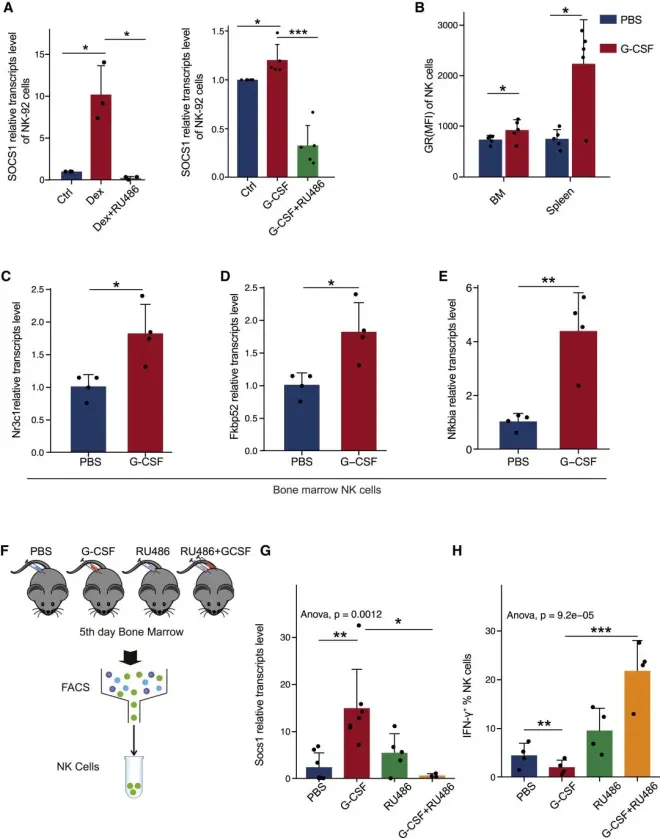
图4 GRs上调SOCS1和抑制IFN-γ的表达
接着,作者探讨了GR在G-CSF处理后如何上调SOCS1的表达。采用Hi-C技术分析了人骨髓NK细胞的全基因组相互作用信息,结果显示GC处理可增强G-CSF诱导基因的染色质与远端区域相互作用,即G-CSF诱导基因的染色质形成一个环状结构。此外,ATAC-seq和GR CUT&Tag分析结果显示,G-CSF处理后,位于与G-CSF诱导基因相关的染色质环中的可及性明显增加,并且具有更强烈的GR结合信号。因此,说明在G-CSF处理后,增加了G-CSF诱导的基因与远端GR结合位点的相互作用。

图5 增强G-CSF诱导基因启动子与远端GRs结合位点相互作用
最后,作者推测SOCS1的上调,与G-CSF激活GR,增强GR与G-CSF诱导基因的相互作用有关。实验结果证实,GR可与SOCS1的第一个增强子(E1)结合,与第二个增强子(E2)有较弱的结合,此外E1结合的活化组蛋白H3K27ac水平高于E2。提示GR结合促进了SOCS1 E1、E2和启动子之间的相互作用。随后的NK细胞CTCF ChIP-seq数据表明,CTCF可与SOCS1启动子和E1附近的区域结合,促进E1和启动子的成环。用Hi-C实验数据对SOCS1启动子进行虚拟4C分析,结果显示,经G-CSF处理后,SOCS1启动子与E1/E2之间的相互作用频率显著增加。上述结果表明GR与SOCS1增强子结合,促进了增强子—启动子的相互作用并增加了染色质的可及性,这可能是G-CSF处理后SOCS1表达增加的原因。

图6 GRs促进SOCS1基因启动子和增强子的相互作用
综上所述,本研究利用了整合基因组策略来揭示G-CSF抑制IFN-γ分泌的机制。作者证明了GR由G-CSF激活,并介导了G-CSF处理的NK细胞中基因组反应。而活化的GR可促进SOCS1启动子和增强子之间的相互作用,上调SOCS1的表达,从而抑制IFN-γ的分泌。这些结果在小鼠实验中均得到验证。作者揭示了NK细胞分泌IFN-γ依赖于GR/SOCS1的调节机制,为COVID-19等炎症性疾病提供了潜在的干预和治疗途径。
参考文献:
[1] Alexander WS, Starr R, Fenner JE, Scott CL, Handman E, Sprigg NS, Corbin JE, Cornish AL, Darwiche R, Owczarek CM, Kay TW, Nicola NA, Hertzog PJ, Metcalf D, Hilton DJ. SOCS1 is a critical inhibitor of interferon gamma signaling and prevents the potentially fatal neonatal actions of this cytokine. Cell. 1999 Sep 3;98(5):597-608.

