“长寿药”NMN促癌?是无“疾”而终还是为“癌”发电?

导读
NMN等NAD+补剂促癌吗?
我们以及我们所邀请的学术专家,在不同场合多次回复过这类问题。为了就该问题进行阶段性系统总结,给“想要抗衰但不想得癌”的读者一个交代,我们查阅了十年NMN、NAD+与肿瘤的研究,理清普通读者、肿瘤患者读者的疑虑,包括:
1) NMN、NAD+是帮助还是干扰癌症治疗?
2) NMN、NAD+是否会促进健康人患癌?
3) NAD+整个代谢网络有多少因素与癌症发生或加剧有关?
4) 我们应如何看待现在的NMN、NAD+代谢在癌症研究中的不同声音?
此外,文末我们也会附上一些查阅资料后的观点,请大家耐心阅读。
随着年龄增加,人体代谢发生转变,NAD+的变化尤其突出。增强NAD+在衰老相关疾病,包括癌症中表现出益处。

NMN对癌症的正面作用主要体现在3个方面:延缓衰老从而降低癌症发生发展的风险,强化免疫系统功能,以及减少癌症治疗对器官机能的损害。[1]

癌症是衰老相关疾病,因此,NMN补剂作为抗衰老策略,有预防癌症的研究证据也不足为奇。
案例一:维稳线粒体,防治肿瘤和神经退行性疾病
2021年发表于Curr Med Chem的综述回顾了诸多NMN与线粒体的相关研究,发现维持NAD+池、维持较好的NAD+/NADH浓度比值,有益于维持线粒体正常功能,并且有助于维持各NAD+消耗酶(通常与衰老调控相关)如Sirtuins、聚ADP-核糖聚合酶和CD38/157酶的催化活性。
文章认为:包括NMN在内的NAD+补充剂可以作为肿瘤和神经退行性疾病的潜在疗养措施(a possible therapeutic approach)。[2]

案例二:预防肝癌
在健康细胞向癌细胞转变的过程中,DNA损伤修复不及时是重要原因。
早在2014年Cancer Cell、2015年Oncoscience杂志就先后刊登研究,表明在癌基因诱导的肝细胞癌(HCC)发生过程中,NAD+从头合成被抑制导致DNA损伤修复困难,是癌症发生的重要原因。
作者认为,倘若在癌基因激活后、HCC发生之前及时补充NAD+,可以一定程度维护肝脏健康,避免悲剧发生(见下图)。但该文同时表示:非癌基因所致的肝癌是否也从NAD+补剂获益尚不得而知。[3]

直到近期,关于NAD+预防肝癌的新证据出现了。
肝纤维化(俗称肝硬化)可能发展成肝癌,而肝星状细胞 (HSC) 是驱动肝纤维化进展的重要因素。
2021年发表于Free Radic Biol Med的哺乳动物研究[4]发现,NMN抑制氧化反应介导的15-OGDH降解,促进前列腺素E2降解并抑制HSC活化;由于HSC活性被抑制,其细胞内的促肝纤维化基因难以转录表达出促肝纤维化的蛋白质,从而预防了肝纤维化的发生发展。
文章认为,补充NMN不失为预防肝纤维化所致肝硬化、肝癌的新策略。
案例三:预防紫外线所致皮肤光老化
紫外线造成皮肤光老化,不仅会让人容貌出现老态,也会增加黑色素瘤、非黑色素瘤皮肤癌的风险。
2021年重庆教育学院在Front Pharmacol发表研究[5]:联合使用NMN与发酵乳杆菌(L.TKSN041)能显著增强小鼠超氧化物歧化酶SOD、过氧化氢酶CAT水平,降低氧化损伤和糖基化终产物,增加皮肤中的NAD+,预防小鼠在UVB紫外线损伤下出现的皮肤老化与病变。

癌症的发生发展机制很复杂,至今尚未完全明晰。然后从已有信息来看,不同癌症“受用”的疗法有所差别。
近年来,已证实NMN通过延缓免疫细胞衰老、增强免疫细胞功能等机制,在免疫疗法(PD-L1相关)、CAR-T疗法、NK细胞疗法等癌症疗法中发挥积极作用。
案例一:NMN增加免疫疗法药性
免疫疗法简介:
PD-L1是常常于肿瘤细胞表面表达、与肿瘤发生免疫逃逸相关的蛋白。如果肿瘤细胞表面的PD-L1足够多,对肿瘤细胞采用免疫疗法的治疗效果就更好(更不容易损伤到健康细胞)。

2020年,由第二军医大学东方肝胆医院、复旦大学附属肿瘤医院发表于Cell Metabolism的研究[6]表明:NAD+充足,可触发NAMPT-TET1-p-STAT1-IRF1-PD-L1细胞级联反应,促进癌细胞表面上表达更高水平的PD-L1蛋白质,从而增强免疫疗法的癌症治疗效果。



图:NMN配合免疫疗法(紫色折线)造成肿瘤质量、体积下降
案例二:NMN增强NK细胞破坏癌细胞的能力
自然杀伤细胞(NK细胞)是人体免疫系统中的“巡逻兵”,它们可对受感染细胞、老化和病变细胞进行识别与杀害。
研究表明随着年龄增长,NK细胞表达免疫衰老标志物,并且细胞活性逐渐降低。

图:针对KAT7的基因疗法延长了小鼠的健康期和寿命
2021年,日本学者发表于Biomed Res的研究[8]发现,口服或注射NMN,可以强化年轻和老年小鼠的NK细胞对癌细胞的杀伤力,且不影响NK细胞的数量(即:增强单个NK细胞能力,而非靠增殖取胜)。
案例三:NMN增加CAR-T疗法药效
2022年4月,首都医科大学北京世纪坛医院拟发表的研究[22]显示:NMN对CAR-T(嵌合抗原受体修饰的T细胞靶向疗法,用于血液系统恶性肿瘤治疗)具有辅助增强作用。
NMN可以增强CAR-T细胞中的NAD+水平,保护CAR-T细胞端粒长度,并改善CAR-T细胞增殖能力、减少凋亡。高通量检测表明NMN通过上调CAR-T中的Sirt1,下调NF-κB等因子来增强CAR-T的功效和寿命。

图:NMN(实线)增强CAR-T的增殖能力(虚线为对照组)

图:NMN(黑色)保护CAR-T细胞的端粒(白色为对照组)

图:CAR-T抗癌功效被NMN(蓝色)增强(肿瘤控制越好曲线越低)
由于CAR-T对血液恶性肿瘤治疗的一大弱点就是CAR-T的细胞衰老,因此,本文作者对联用NMN改善CAR-T抗癌效率很有信心。

前文虽提到了一些新兴疗法,但癌症治疗中不可或缺的中流砥柱仍是化疗(chemotherapy)。
化疗能够有效杀灭癌细胞,但会对人的健康细胞也造成不可磨灭的损伤,在衰老细胞研究领域,已基本达成共识:化疗会造成衰老细胞增多、器官功能受损,患者衰老显著加速。这是化疗患者后续生活质量大幅下降的主要原因之一。
近两年,国内外知名学术机构发掘了NMN对化疗损伤的缓解功效,有望成为化疗期间的辅助干预手段。
案例一:缓解顺铂耳毒性
NMN被数项研究证明对化疗危害有辅助修复作用。
2021年由中山大学中山纪念医院耳鼻咽喉科发表于Toxicol Lett的研究[9]表明,NMN提高NAD水平,能够对顺铂(常见化疗药物)治疗的小鼠耳的毛细胞起到保护作用,减少毛细胞损失和变形,保护听力免受顺铂治疗损害。
案例二:缓解顺铂认知损伤
无独有偶,同年由明尼苏达州梅奥诊所神经外科发表于顶级肿瘤期刊Cancer Research的研究[10]证实:顺铂可穿过血脑屏障,抑制脑中NAD+生物合成限速酶NAMPT,导致NAD+不足——这可能是顺铂诱导神经损伤、患者记忆障碍的关键因素。
通过补充NMN增加NAD+水平,顺铂给药的小鼠大脑中神经祖细胞增殖、神经元形态乃至认知功能受损程度显著降低,令人高兴的是:本研究中,顺铂抗肿瘤疗效未受到NMN影响。
由于神经一旦发生损伤,通常是很难完全挽回的,因此本文认为NMN是改善癌症幸存者生活质量的潜在治疗手段。

案例三:缓解多柔比星心脏毒性
除了顺铂,多柔比星(DOX)也是一种广泛使用的有效化疗药物,临床用于治疗乳腺癌、膀胱癌、卡波西肉瘤、淋巴瘤和急性淋巴细胞白血病等。多柔比星常与其他化疗药联合使用,然而它具有剂量依赖性心脏毒性。
2021年底,四川大学华西医院放射科发表于Arch Biochem biophys杂志的研究[11]发现:
①NMN抑制DOX诱导的大鼠体内NLRP3小体介导的炎症激活,降低了caspase1、IL-1β活性;
②NMN增加还原性谷胱甘肽(GSH)、超氧化物歧化酶(SOD)2种关键内源性抗氧化剂的活性,降低大鼠体内氧化损伤标志丙二醛(MDA)和活性氧(ROS)的水平。
介于上述分子层面变化,NMN最终表现出减轻DOX诱导大鼠心肌细胞凋亡、心脏纤维化的疗效。

图:NMN改善DOX有诱导的心脏纤维化损伤

除了辅助化疗,也有一些论文报道NMN可能“干扰”抗癌药的抗癌效果。探讨NMN是否干扰化疗并不是他们本意,只是“让癌细胞NAD+耗竭”是很多抗癌新药筛选的重要靶标,NMN或NAD+分子难免被用作检验药理的“试金石”。
这些新药中,谁越是依赖“阻断NAD+”杀死癌细胞,谁就越容易受NAD+前体(不仅是NMN)的影响。
案例一:Syrosingopine+二甲双胍
因发现TOR而获Lasker医学奖(诺奖风向标)的Michael N. Hall发现[12]:为了维持细胞内环境,癌细胞会通过单羧酸转运蛋白1(MCT1)和4(MCT4)排泄糖酵解产物——乳酸。
Hall使用Syrosingopine(西罗辛戈平)联合二甲双胍,引发NAD+再生受阻,导致高糖酵解的癌细胞因缺乏ATP死亡——可谓二甲抗癌新用途。
为验证两药联用起效机制确实与NAD+、ATP有关,他对癌细胞使用了“超出生理水平”(supra-physiological concentrations)剂量的NAD+或NMN,果不其然,癌细胞ATP暂时得到挽救,药效暂时受到了影响。

图:80mM的NMN外源性处理或NAD+处理,挽救了联合用药所致的ATP耗竭(RLU为ATP含量度量方法:相对光单位)
案例二:panobinostat+marizomib
发表于Sci Transl Med的研究[13]用高通量手段从数千种神经胶质瘤 (DMG)候选药物中筛选了一种有希望的联合给药方式:多组蛋白去乙酰化酶 (HDAC) 抑制剂panobinostat和蛋白酶体抑制剂marizomib。
阻断癌细胞NAD+是该方案的起效机制之一,因此充足的NAD+会影响药物疗效。

以上疗法都可算具有潜力的抗肿瘤疗法,但未必能成为普及临床的成熟疗法;而我们前文“NMN辅助治疗、改善副作用”的研究对象则是经典化疗用药。
这提示我们:不同药物受到NMN的影响是不同的,还需持续对该领域保持关注。
在下周二的本次直播中,Baur教授讨论了NAD+前体在临床前和临床实验中没有发挥预期效果的研究,并客观分析了原因,点击下方预约直播↓↓↓

相比是否干扰癌症患者治疗,我们相信普通消费者更关心NMN是否促癌。
争议:NMN是否使健康人发生癌症?无有力证据
美国宾夕法尼亚大学生理学系Zhang Rugang等人2019年在Nature Cell Biology发布了一篇倡议谨慎使用NAD+补充剂的论文[14]:
使用实验室改造的、胰腺上皮内瘤变(PanIN)小鼠进行NMN大剂量腹腔注射(500mg/kg体重),13天后发现NMN促进了病变区域的增加。由此作者认为:NMN可能加速了癌变组织的进一步恶化。

这个研究发布时引来不少关注,但Zhang也没有再深挖该机制,后续热度就变得很小。
2021年,同济大学附属肺科医院的Zhu Junjie等人提出相反意见[15]:用肺癌细胞制作了肺癌肿瘤小鼠,同样给小鼠注射NMN,3周后发现肿瘤既没有变大,也没有变小,反倒是小鼠的体重因NMN而有所减轻。
NMN圈一直是“门内厮杀,门外眼红”,哪个课题组若能证明“NMN促癌”,就能直接把这家伙拉下神坛,一定名声大噪。可惜的是,截止现在,我们难以查到在健康动物体直接使用NMN能促使动物在自然衰老过程中更易患癌的可信证据。
本质:NMN上下游的酶们,在癌中被迫“变态”
除了简单粗暴把NMN喂给、打给动物,在癌症领域,科学家更偏爱“围绕着NAD+代谢”进行一系列癌症机制的研究,这当中最受关注的是NAMPT酶,它在癌圈可比NMN资深多了。
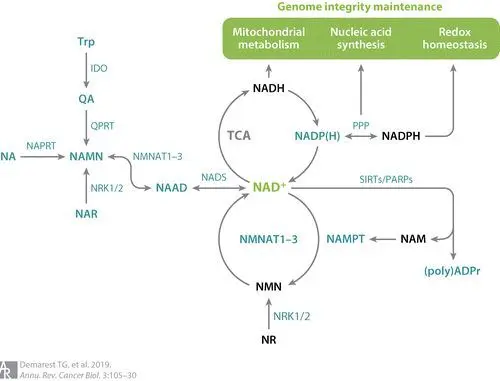
NAMPT是烟酰胺(NAM)合成NMN的必备催化酶,也是细胞分化/去分化、炎症、代谢的调节因子。
多种癌症中NAMPT的基因出现了突变[16],这使得NAMPT增多,诱导肿瘤血管生成、癌细胞增殖以及癌症转移。
此外,上调的NAMPT导致高NAD+合成,NAD+、某些氨基酸是癌细胞生存必须得能源;NAMPT异常还会导致癌细胞中NAM含量降低——由于NAM对Sirt1有抑制作用,因此癌细胞中Sirt1的活性也就增加了(对,就是那个“长寿蛋白”sirtuins)。
使用NAMPT抑制剂也显示出对某些癌细胞的抑制效果,然而对正常细胞而言这种化合物却可能是有毒甚至致命的。
NMNAT是NMN合成NAD+最终步骤的催化酶,分为1-3亚型,在中枢神经保护、维持细胞内NAD+池等方面至关重要,它的突变会导致功能下降,经年累月导致神经元病变、神经退行性疾病发生[17, 18]。
然而,NMNAT也与肿瘤有关,在结肠癌、神经母细胞瘤、黑色素瘤样本中,科学家发现NMNAT2异常增多。与NAMPT抑制剂相似,开发靶向局部肿瘤病灶的NMNAT抑制剂,或许也不失为有潜力的特定肿瘤治疗手段。
NAPRT是NAD+烟酸合成途径(preiss-handler)的催化酶,可以说和NMN关系很远了。它也被证实在胰腺癌、卵巢癌等癌症中异常高表达[19]。
NAMPT、NMNAT、MAPRT等NAD+合成催化酶各自在不同种类的癌症中被上调或下调,如果是在癌症中被上调,则通过局部抑制这些酶,能够掐断癌细胞“粮食”,增强化疗效果[20]。
由此可见,NAMPT、NMNAT、NAPRT、NAD+、sirtuins“见人说人话,见鬼说鬼话”,在正常机体可抗衰老、强化免疫屏障,在肿瘤中又兼职做坏细胞的燃料。
小结
以上就是目前关于NMN、癌症科学界开展研究的主要方向。
文章较长,关于NMN对癌症的影响,我们小结如下:
●益处:NMN被论证可从线粒体等角度抗衰老,也可调节免疫,这两种作用机制或可降低癌症的发生风险;
●益处:NMN在经典化疗药物用药中表现出机体保护作用,可能有助于缓解副作用;
●益处:NMN对免疫治疗(PD-L1)、CAR-T、NK细胞疗法等肿瘤治疗手段中起强化治疗作用;
●风险:对于一些以耗竭癌细胞NAD+、ATP为靶标的潜在药物分子(尚处于临床初期,离成为经典方案还很远),外源性给癌细胞补充NAD+可能导致药效打折——对于此类情况,使用文中提到panobinostat+marizomib、Syrosingopine+二甲双胍联合抗癌防癌的患者需遵医嘱,谨慎服用;
●争议:关于NMN是否促进已经患癌个体的病情加重的研究不多,且有争议,一些研究认为已经发生癌变的组织会因NMN大剂量使用病情恶化,一些研究则发现单独使用NMN不影响癌症进展。
关于NMN是否促进癌症发生,普通人不用太担心。
首先,目前没有可重复的、公认的研究证明NMN可以促进正常细胞转变为癌细胞;
其次NAD+增多(或流通量变大)是癌变后的代谢异常,而非起因。若要倒转科学研究的先与后、因与果,那葡萄糖、氨基酸(癌症最爱的养料)都有罪。
最后,上述NMN干扰抗癌药效、促进癌症发生或恶化的研究中所使用的研究模型很多都是体外细胞模型;用于“浸泡”癌细胞的NMN浓度,用Hall的话说也是“超生理的浓度”。
我们手中几百毫克的NAD+口服前体,相较癌细胞对NAD+张开的“血盆大口”,相较NMN“负面报道”所使用的剂量,很可能只是蚂蚁见大象的程度了。
除了NMN本身,我们在文章后半部分亦关注了NMN代谢圈真正的“癌症研究热点”——各种NAD+代谢酶(NAMPT、NMNATs)。
在阅读远多于本文所体现的研究资料后,我们以为:在癌症进展中,NAD+代谢网络的代谢物、催化酶们或许是“在癌中变态”的从众者[20],而非令人生畏的将领。
早在十年前,一线期刊PNAS就发表了“c-myc(知名的iPSC山中因子)是NAMPT上游调控因子”的结论,它促使NAMPT→NAD+→SIRT、PARPs发生一系列异常,最终塑造出疯狂糖酵解+合成代谢的癌细胞生存模式。
由于文章篇幅过长,信息过多,我们就不再继续罗列了。完成本文所需的资料收集截止至2022年7月初。由于NMN领域论文良莠不齐,翻阅过程中难免有所疏漏,我们希望大家一起关注NAD+代谢与肿瘤,也欢迎大家讨论、赐教。




附表:NAD+代谢网中被不同癌症“代谢重编程”的分子[21]
—— TIMEPIE ——
这里是只做最硬核续命学研究的时光派,专注“长寿科技”科普。日以继夜翻阅文献撰稿只为给你带来最新、最全前沿抗衰资讯,欢迎评论区留下你的观点和疑惑;日更动力源自你的关注与分享,抗衰路上与你并肩同行!

[1]Garrido, A. and N. Djouder, NAD(+) Deficits in Age-Related Diseases and Cancer. Trends Cancer, 2017. 3(8): p. 593-610.
[2] Poltronieri, P., et al., NAD Precursors, Mitochondria Targeting Compounds and ADP-Ribosylation Inhibitors in Treatment of Inflammatory Diseases and Cancer. Curr Med Chem, 2021. 28(41): p. 8453-8479.
[3] Tummala, K.S., et al., Inhibition of de novo NAD(+) synthesis by oncogenic URI causes liver tumorigenesis through DNA damage. Cancer Cell, 2014. 26(6): p. 826-839.
[4] Zong, Z., et al., Nicotinamide mononucleotide inhibits hepatic stellate cell activation to prevent liver fibrosis via promoting PGE2 degradation. Free Radic Biol Med, 2021. 162: p. 571-581.
[5] Zhou, X., et al., Nicotinamide Mononucleotide Combined With Lactobacillus fermentum TKSN041 Reduces the Photoaging Damage in Murine Skin by Activating AMPK Signaling Pathway. Front Pharmacol, 2021. 12: p. 643089.
[6] Lv, H., et al., NAD(+) Metabolism Maintains Inducible PD-L1 Expression to Drive Tumor Immune Evasion. Cell Metab, 2021. 33(1): p. 110-127 e5.
[7] Przemska-Kosicka, A., et al., Age-Related Changes in the Natural Killer Cell Response to Seasonal Influenza Vaccination Are Not Influenced by a Synbiotic: a Randomised Controlled Trial. Front Immunol, 2018. 9: p. 591.
[8] Takeda, K. and K. Okumura, Nicotinamide mononucleotide augments the cytotoxic activity of natural killer cells in young and elderly mice. Biomed Res, 2021. 42(5): p. 173-179.
[9] Zhan, T., et al., Modulation of NAD(+) biosynthesis activates SIRT1 and resists cisplatin-induced ototoxicity. Toxicol Lett, 2021. 349: p. 115-123.
[10] Yoo, K.H., et al., Nicotinamide Mononucleotide Prevents Cisplatin-Induced Cognitive Impairments. Cancer Res, 2021. 81(13): p. 3727-3737.
[11] Wan, Y., et al., Nicotinamide mononucleotide attenuates doxorubicin-induced cardiotoxicity by reducing oxidative stress, inflammation and apoptosis in rats. Arch Biochem Biophys, 2021. 712: p. 109050.
[12] Benjamin, D., et al., Dual Inhibition of the Lactate Transporters MCT1 and MCT4 Is Synthetic Lethal with Metformin due to NAD+ Depletion in Cancer Cells. Cell Rep, 2018. 25(11): p. 3047-3058 e4.
[13] Lin, G.L., et al., Therapeutic strategies for diffuse midline glioma from high-throughput combination drug screening. Sci Transl Med, 2019. 11(519).
[14] Nacarelli, T., et al., NAD(+) metabolism governs the proinflammatory senescence-associated secretome. Nat Cell Biol, 2019. 21(3): p. 397-407.
[15] Effect of β-nicotinamide mononucleotide on tumor formation and growth in a lung cancer mouse model. Materials Chemistry Frontiers.
[16] Lin, T.-C., Updated Functional Roles of NAMPT in Carcinogenesis and Therapeutic Niches. Cancers, 2022. 14(9): p. 2059.
[17] Liu, F., et al., A genomewide screen for late-onset Alzheimer disease in a genetically isolated Dutch population. Am J Hum Genet, 2007. 81(1): p. 17-31.
[18] Ljungberg, M.C., et al., CREB-activity and nmnat2 transcription are down-regulated prior to neurodegeneration, while NMNAT2 over-expression is neuroprotective, in a mouse model of human tauopathy. Hum Mol Genet, 2012. 21(2): p. 251-67.
[19] Piacente, F., et al., Nicotinic Acid Phosphoribosyltransferase Regulates Cancer Cell Metabolism, Susceptibility to NAMPT Inhibitors, and DNA Repair. Cancer Res, 2017. 77(14): p. 3857-3869.
[20] Menssen, A., et al., The c-MYC oncoprotein, the NAMPT enzyme, the SIRT1-inhibitor DBC1, and the SIRT1 deacetylase form a positive feedback loop. Proc Natl Acad Sci U S A, 2012. 109(4): p. E187-96.
[21] Demarest, T.G., et al., NAD+ Metabolism in Aging and Cancer. Annual Review of Cancer Biology, 2019. 3(1): p. 105-130.
[22] Yu, Z., et al., Nicotinamide mononucleotide enhances the efficacy and persistence of CD19 CAR-T cells via NAD + –Sirt1 axis. https://doi.org/10.21203/rs.3.rs-1483519/v1

