2022年疫苗行业报告:RSV疫苗曙光初现,百亿美元市场待发掘!
报告出品/作者:国信证券、陈益凌、马千里
以下为报告原文节选
------
RSV 是一种副黏病毒科肺炎病毒属的负单链 RNA 病毒
◼ 呼吸道合胞病毒(Respiratory syncytial virus,RSV)是一种副黏病毒科肺炎病毒属的负单链RNA病毒,1956年从黑猩猩呼吸道中首次分离,由于和呼吸道感染关,并且能把感染的细胞融合起来,因此得名。
◼ RSV基因组全长约15.2kb,共10个基因编码11个蛋白质,包括非结构蛋白(NS1、NS2)、包膜蛋白(黏附蛋白G、融合蛋白F、基质蛋白M、小疏水蛋白SH)、核糖体蛋白(核蛋白N、磷蛋白P、多聚酶亚单位蛋白L、M2-1、M2-2)。其中,G G 和F F 蛋白是 RSV膜表面2 2 个重要的跨膜蛋白,即介导吸附的G G 蛋白和介导胞膜融合及穿入的F F 蛋白是病毒的两个主要保护性抗原。

RSV 在婴幼儿和老年人群体中疾病负担较重
◼ 据估计全球范围内,几乎所有儿童在2岁前均感染过呼吸道合胞病毒,其中~40%发展为LRTI,6月龄以下可见较重病例(可能与婴幼儿免疫系统不完善相关)。2019年在全球范围内,5岁以下儿童中有3300万次RSV相关的急性下呼吸道感染比例,导致360万人次住院,10.1万例死亡(其中2.6万例院内死亡),占该年龄段年度全因死亡的~2%。对于6月龄以下儿童,2019年全球有660万例RSV相关的急性下呼吸道感染比例,140万人次住院,4.6万例死亡(其中1.3万例院内死亡),占该年龄段年度全因死亡的~2.6%。
◼ 美国:儿童毛细支气管炎和肺炎的最常见原因,每年5岁以下儿童210万次门诊、5.8万例住院、100~300例死亡
◼ 中国:每年约有61.9万~94.8万5岁以下儿童因RSV感染而住院,其中婴儿21.5万~50.0万


RSV 在婴幼儿和老年人群体中疾病负担较重(续)
◼ 老年人的感染风险也相对较高,并且由于免疫力下降和基础疾病,出现严重疾病的风险更高。根据US CDC估计,在美国RSV感染每年导致17.7万65岁以上老年人住院,1.4万例死亡,每年估计导致30亿美元的年度医疗支出。
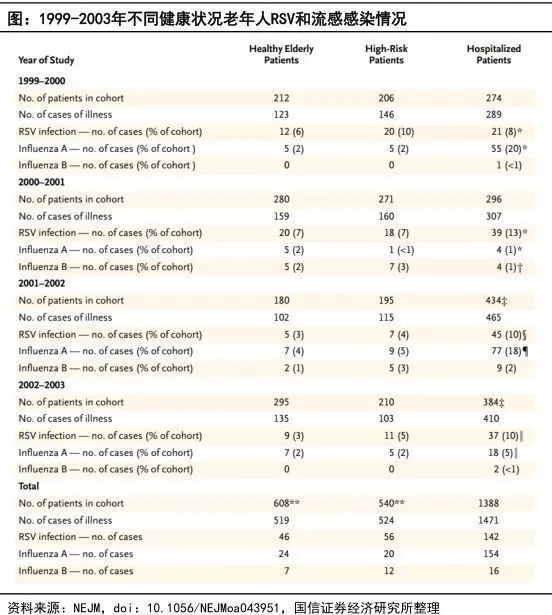
◼ 根据1999-2003年,连续四个冬季对于健康老年患者(≥65 岁)和高危成人(慢性心肺疾病患者)和急性心肺疾病住院患者的所有呼吸系统疾病的队列研究:
• 年感染率:每年有3~7%的健康老年人和4~10%的高危人群发生RSV感染
• 健康老年人(RSV:46 vs 流感:31)和高危成人(RSV:56 vs 流感:32)RSV病例数高于流感
• 住院患者:RSV和流感病例数及相应住院时长相似,ICU使用率分别为15/12%,死亡率分别为8/7%
RSV 感染长期缺乏有效防治手段
RSV病毒首次发现至今已超过60年,但全球尚无有效预防和治疗药物上市,儿童和老年人等高危人群感染后治疗方法以对症支持治疗/缓解症状为主,因此预防是RSV管理的关键;同时,自然感染RSV无法诱导针对保守免疫原的长期免疫记忆反应,RSV免疫预防需要依靠被动预防(抗体药物)或主动预防(预防性疫苗):
◼ 主动预防:早在上世纪60年代初,Pfizer就开发了一种甲醛灭活RSV疫苗(FI-RSV,formalin-inactivated RSV),利用Vero细胞扩增病毒样本+甲醛灭活,通过2/3剂次免疫程序(0/1月、0/1/2月或0/1/4月)在2月龄~10岁婴幼儿群体中诱导高水平体液免疫并展现出良好的安全性,但在临床研究9个月后的RSV流行季中,FI-RSV组受试儿童出现高比例严重呼吸系统疾病(ERD,Enhanced respiratory disease),可能由于FI-RSV诱导Th2型T细胞免疫应答,从而导致相关细胞因子介导的肺炎发生;同时,FI-RSV诱导中和抗体保护能力不足并产生了抗体诱导的疾病增强(ADE)。 2013 年融合前 (pre- - fusion , Pre- - F) 蛋白结构解析后,以 pre- -F F 构象为基础的 RSV疫苗研发进入加速发展阶段;
◼ 被动预防:按照获得方式不同,RSV被动免疫制剂可分为天然被动免疫(母传抗体)和人工被动免疫(预防用抗体)。1998年FDA批准AstraZeneca的Synagis(Palivizumab,帕利珠单抗)用于具有高危因素特殊婴幼儿预防RSV感染Synagis是一款人鼠嵌合型单抗,靶向Pre-F和Post-F蛋白的site II表位,美国儿科学会指南推荐患有显著血流动力学异常心脏疾病及慢性肺疾病的早产儿(胎龄32周以下,在新生儿期使用过体积分数超过210 mL/L氧气)在1岁内使用,在当地RSV流行前1个月开始,15mg/kg/次剂量,每月1次肌内注射,最多连用5个月。帕丽珠单抗可防止RSV感染后疾病进展(与安慰剂相比降低55%住院风险),但其不能治愈或治疗已经患有严重RSV感染相关疾病的儿童,并不能完全防止RSV感染发生。
pre- -F F 构象成为抗体和疫苗研发重点
◼ RSV的F蛋白以三聚体形式存在,在各亚型间高度保守,具有融合前pre-F和融合后post-F两种构象,其中pre-F构象是一种亚稳定结构,可向稳定的post-F构象转变。目前已发现pre-F具有全部6种抗原表位(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ø),而post-F仅有4种表位(Ⅰ、Ⅱ、Ⅲ和Ⅳ),其中pre-F特有的抗原表位Ø诱导中和抗体能力高于其他抗原表位(可能由于Ø更充分暴露于pre-F构象顶端),并且自然感染产生的高中和抗体也主要识别pre-F构象,因此pre-F构象成为预防抗体和疫苗研发重点。

多款基于 pre- -F F 抗原开发的疫苗和抗体产品处于临床后期阶段
◼ 目前全球共有基于pre-F抗原开发的6款疫苗和2款单抗产品处于Ph3临床阶段,其中GSK的RSVpreF3和Pfizer的RSVpreF两款重组RSV疫苗产品60岁以上老年人Ph3临床取得积极数据,报产在即;AstraZeneca/Sanofi合作开发的婴幼儿RSV预防抗体Beyfortus(nirsevimab)获得CHMP(欧盟人用药品委员会)上市许可推荐。

Novavax :x ResVax Ph3 临床失败
ResVax是Novavax研发的重组纳米蛋白颗粒RSV疫苗:
◼ 疫苗设计:全长F蛋白Pre-fusogenic构象±Alum(60岁以上老年人剂型无佐剂,孕妇剂型使用铝佐剂)
◼ 剂量程序:单剂次,135μg剂量(老年人)或120μg剂量(孕妇)
◼ 临床数据
• Ph3 60岁以上老年人临床研究:2016.09宣布失败,共入组11856人,对于预防RSV相关的中/重度下呼吸道感染VE=-7.9%,对所有和RSV相关的疾病的VE=12.6%,未达到主要临床终点
• Ph3 PREPARE孕妇临床研究:2019.02宣布失败,共入组约4600人,对于预防新生儿90天RSV相关有临床意义的下呼吸道感染VE=39.4%、预防RSV相关住院VE=44%、预防伴有严重低血氧症的RSV LRTI的VE=48%,均低于WHO推荐的50%有效率

GSK : RSVPreF3 OA 针对 60 岁以上老年人 Ph3 临床取得积极中期数据
RSVPreF3 OA 是 GSK 研发的双价 RSV 重组蛋白疫苗
◼ 疫苗设计:A/B亚型前融合构象的F蛋白(RSVPreF3)+AS01佐剂(MPL+ QS-21)◼ 用法剂量:单剂次
◼ Ph3 AReSVi-006研究(NCT)数据:17个国家共计入组60岁以上老年人约2.5万人
• 总体保护效力达到82.6%(疫苗组:7/12466 vs 对照组:40/12494)
• 对于RSV相关的严重下呼吸道疾病(LRTD-RSV,至少伴有2种及以上下呼吸道症状或由研究员评估并经外部裁决委员会确认的严重症状)保护效力达到94.1%(1/12466 vs 17/12494)
• 具有既往慢病史(心血管、呼吸系统和内分泌疾病)人群保护效力为94.6%(1/4937 vs 18/4861)
• 高龄受试者(70~79岁)保护效力为93.8%(1/4487 vs16/4487)
• 预防A型(VE=84.6%)和B型(VE=80.9%)RSV感染展现出高水平且一致的保护效力

Pfizer : RSVpreF 针对 60 岁以上老年人 Ph3 临床取得积极中期数据
RSVpreF是Pfizer研发的一款RSV双价重组蛋白疫苗:
◼ 疫苗设计:A/B亚型前融合构象的F蛋白
◼ 用法剂量:120μg单剂次
◼ 临床进展
• Ph3 RENOIR研究(NCT05035212):入组60岁以上老年人约3.7万人,避免RSV相关下呼吸道疾病(LRTI-RSV,定义为出现至少2个以上的症状)保护效力达到66.7%,避免出现3个以上严重症状的LRTI-RSV保护效力达到85.7%
• Ph2b 孕妇临床研究:招募孕24至36周的孕妇,分别接种120或240μg RSVpreF疫苗(±铝佐剂)或安慰剂,疫苗组RSV-A/B抗体50%中和能力分别达到对照组的9.7~11.7x以及13.6~16.8x,胎盘中和抗体转移率为1.41~2.10,其中无佐剂组高于佐剂组,RSVpreF疫苗可以通过胎盘转移高效诱导中和抗体反应
• Ph3 MATISSE研究(NCT04424316):2020.06启动,入组约1万人,评估单剂量RSVpreF对怀孕个体的疗效和安全性,主要终点为预防新生儿RSV LRTI
J&J/ Jassen :F Ad26.RSV.preF 60 岁以上老年人 Ph3 临床进行中
◼ 疫苗设计:全长pre-F构象(“GSGSGR”替代p27和furin酶切位点,Fibritin序列替代C端跨膜和胞内段)+Ad26载体
◼ 剂量程序:1剂,1x10e11vp
◼ 临床进展
• Ph2攻毒研究(NCT03334695):15~50岁健康受试者1:1接种Ad26.RSV.preF或安慰剂后28天进行RSV-A病毒鼻喷暴露,相对于安慰剂组,疫苗组病毒载量显著降低
• Ph3 EVERGREEN研究(NCT04908683):2021.06启动,入组60岁以上老年人约2.7万人,主要终点为单剂次接种后LRTD感染率
• 中国Ph3临床研究(CTR20221418):2022.06启动,入组60岁以上老年人3600人


Moderna :老年人 Ph3 临床入组中
mRNA-1345(老年人Ph3/儿童Ph1)
◼ 抗原设计:融合前构象(prefusion)F蛋白
◼ 递送系统:LNP
◼ Ph1临床研究:18-49岁成年受试者,50μg(N=18)和100μg(N=19)剂量组,单次接种后1个月针对RSV-A和RSV-B的中和抗体GMT分别达到~20.5倍和~11.7倍
◼ Ph3 ConquerRSV研究:
• 临床设计:计划在20+国家招募60岁以上受试者34000名(截至2022年9月入组约2.4万人,预计年底前完成全部入组)
• 主要终点:接种后首个RSV流行季对于2种及以上LRTD症状、2种及以上LRTD症状、RSV相关住院、RSV相关的严重呼吸道疾病预防的有效性
◼ 2款含RSV多联呼吸道疾病预防疫苗处于临床前阶段
• mRNA-1230:新冠+流感+RSV
• mRNA-1365:RSV+hMPV(儿童)

Sanofi/AstraZeneca : Nirsevimab 获得 CHMP(欧盟人用药品委员会)上市许可推荐Beyfortus(nirsevimab)是AstraZeneca和Sanofi合作研发的一款长效单抗药物,用于婴幼儿预防其首个RSV流行季由RSV病毒感染所导致的下呼吸道疾病
◼ 药物设计:靶向pre-F蛋白Ø表位,修饰蛋白Fc区(M252Y/S254T/T256E(YTE)突变)延长半衰期(人体内半衰期63~73d,单剂可提供5个月保护效果)的全人源重组IgG1k单抗
◼ 用法用量:50mg(体重<5kg)/100mg(体重≥5kg)单剂肌肉注射
◼ Ph3 MELODY 研究数据:与单剂安慰剂组相比,Beyfortus用药150天后,在RSV流行季中因RSV感染所造成需医疗照护的下呼吸道感染发生率显著降低。ITT(意向治疗)群体混合数据显示,与安慰剂组(N=786)相比,Beyfortus组(N=1564)相对风险下降79.5%(避免产生如细支气管炎、肺炎等下呼吸道感染的风险)
◼ 安全性:与获批疗法Synagis(Palivizumab,预防在高风险与早产婴儿中因RSV引起的下呼吸道感染,最多需接种5剂次)相似的安全性与耐受性,两组病患的治疗伴发不良反应(TEAE)与治疗伴发严重不良反应(TESAE)发生率类似

Merck : Clesrovimab/MK- - 1654 婴幼儿 Ph3 临床进行中
Clesrovimab/MK-1654是Merck开发的一款全人源RSV长效中和抗体
◼ 药物设计:靶向F蛋白的Ⅳ位点(Fc片段YTE改造延长半衰期)
◼ 用法用量:单剂次肌肉注射
◼ 临床进展
• Ph1/2 临床研究(NCT03524118):100/300mg肌注或300/1000/3000mg静注,最大血药浓度在肌注后6~10天观察到,药物半衰期约为70~85天
• Ph2b/3 临床研究(NCT04767373):入组3300名健康早产儿和足月婴儿,正在进行中

-----------报告摘录结束 更多内容请阅读报告原文-----------
报告合集专题一览 X 由【虎鲸报告】定期整理更新
医疗 / 健康 / 养老 /
医疗器械 | 体外诊断 | IVD | POCT | 医疗影像 | 医药产业 | 生物医药 | 医药电商 | 康复医疗 | 医疗信息化 | 智慧医疗 | 互联网医疗 | 远程医疗 |医疗机器人 | 医疗大数据 | 医疗耗材 | 医疗设备 | 儿科医疗 | 高端医疗 | 海外医疗 | 医疗租赁 | 眼科医疗 | 医疗租赁 | HMO美国医疗 | 大健康 | 健康体检 | 运动健康 | 女性健康 | 保健品 | 医疗美容 | 整形 | 美容仪器 | 连锁医院 | 民办诊所医院 | 宠物医院 | 互联网医院 | 医生人群 | 养老产业 | 养老地产 | 银发人群 | 人口老龄化 |
(特别说明:本文来源于公开资料,摘录内容仅供参考,不构成任何投资建议,如需使用请参阅报告原文。)

