高中化学重要气体的实验室制法,一节课全通!

当你第一次开始学它
你会看见满眼的叉叉
它会有机 实验 平衡
变傻-你以为自己要被打趴
直到你偶然遇见了他
你会眼里泛着泪花
一化辞典学基础
考点精华学解题
还想看啥直接私信去找他!
当你已经看完了它
化学变成热情的小哈
它会卖萌 撒娇 考试不用拉闸
化学老师见到了你 也要笑哈哈
哦~ 你也会变成化学大咖!!!
————————————————————————————
高中化学重要气体制备
一节课全通!

气体的发生装置
一般根据反应物状态和反应条件设计气体发生装置
类型A: 固 + 固 —Δ→ 气↑
类型B:液 + 液 —Δ→ 气↑
固 + 液 —Δ→ 气↑

类型C: 液+ 固 —Δ→ 气↑
液 + 液 —Δ→ 气↑
类型D: 液 + 固 —Δ→ 气↑(启普发生器)

制O2 : 1.过氧化氢分解(二氧化锰催化)
2 H2O2 =MnO2= 2 H2O + O2↑
2.加热高锰酸钾
2 KMnO4 =Δ= K2MnO4 + MnO2 + O2↑
3.加热氯酸钾(二氧化锰催化)
2 KClO3 =Δ、MnO2= 2 KCl + 3 O2↑
制CO2: 碳酸钙与盐酸(复分解反应)
CaCO3 + 2 HCl = CaCl2 + H2O + CO2↑
制H2: 锌与稀硫酸(置换反应)
Zn + H2SO4 = ZnSO4 + H2↑

二氧化锰法制Cl2:
MnO2 + 4 HCl(浓) =Δ= MnCl2 + Cl2↑+ 2 H2O
离子方程式:
MnO2 + 2 Cl- + 4 H+ =Δ= Mn2+ + Cl2↑+ 2 H2O

其他Cl2制法
高锰酸钾法:
2KMnO4 + 16HCl(浓)=Δ= 2KCl + 2MnCl2 + 5Cl2↑+8H2O
氯酸钾法:
KClO3 + 6HCl(浓) =Δ= KCl + 3 Cl2↑
次氯酸钠法:
NaClO + 2 HCl = NaCl + Cl2↑+ H2O

重要气体制备:SO2
亚硫酸钠法:
Na2SO3 + H2SO4 = Na2SO4 + SO2↑+ H2O
“氧化”铜法[该方法制得的SO2量少,有杂质(水蒸气)]:
Cu + 2 H2SO4(浓) =Δ= CuSO4 + SO2↑+ 2 H2O

重要气体制备:NH3
氨气的收集方法:
向下排空气法(导管伸人,接近试管底部)。
验满方法:
将湿润的红色石蕊试纸放在管口。
棉花(用水或稀硫酸浸湿)的作用:
防止 NH3与空气对流,吸收多余的 NH3,防止污染空气。
试管口略向下倾斜,防止产生的水蒸气冷凝回流炸裂试管。
反应原理:
2 NH4Cl + Ca(OH)2 =Δ= CaCl2 + 2 NH3 ↑+ 2 H2O
(固+固— Δ →气↑)

氨气的其他制备方法
加热浓氨水法:
NH3•H2O =Δ= NH3↑+ H2O
浓氨水+NaOH(s)法:
NH4+ + OH- =Δ= NH3↑+ H2O
浓氨水+CaO(s)法:
NH3•H2O + CaO =Δ= NH3↑+ Ca(OH)2

重要气体制备:NO/NO2
制NO:
“氧化”铜法:
3 Cu + 8 HNO3(稀) = 3 Cu(NO3)2 + 2 NO↑+ 4 H2O
NO2+NaOH(aq)法:
2 NO2 + 2 NaOH = NaNO3 + NaNO2 + H2O
制NO2:
Cu + 4 HNO3(浓) = Cu(NO3)2 + 2 NO↑+ 2 H2O

重要气体制备:HCl/H2S
制HCl:
NaCl + H2SO4(浓) =微热= NaHSO4 + HCl↑
2NaCl + H2SO4(浓) =Δ= NaHSO4 + HCl↑
制H2S:
FeS + H2SO4(稀) = FeSO4 + H2S↑

重要气体制备:C2H4
C2H5OH —浓H2SO4/170℃→ CH2=CH2↑+ H2O
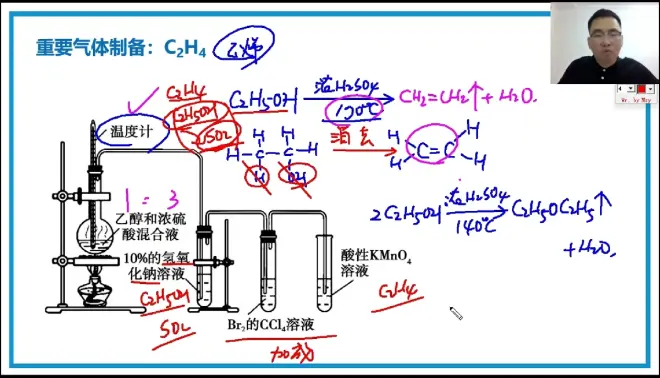
重要气体制备:C2H2
碳化钙(电石)+H2O法:
CaC2 + 2 H2O = Ca(OH)2 + C2H2↑

补充:
重要气体制备:CH4
实验室制甲烷的方法是使用无水醋酸钠和碱石灰反应。该反应需要在严格的无水条件下进行,因此需要使用干燥剂来吸收水蒸气,提供干燥的环境。
反应方程式:CH3COONa + NaOH → Na2CO3 + CH4↑
此外,在实验室中合成甲烷需要使用催化剂,如金属钯。
实验室制甲烷的反应需要严格控制条件,包括压力、温度和湿度、反应时间等,否则反应产物和污染物可能会出现效率低,甚至危害环境的情况。

