去泛素化酶USP16消除RPS27a的单泛素化并促进40S核糖体亚基的成熟
写在前面
今天推荐的是由瑞士苏黎世联邦理工学院生物化学研究所在2020年3月4日发表于eLife(2020IF:8.140,JCRQ1)的一篇文章,通讯作者是UlrikeKutay教授,研究表明USP16消除RPS27a的单泛素化并促进40S核糖体亚基的成熟。
研究背景
核糖体是生命的翻译中心,通过读取信使 RNA (mRNA) 模板催化蛋白质的合成。翻译能力的建立代表了40S核糖体亚基生物发生中决定性的细胞质步骤。这涉及最终的18S rRNA加工和残留生物发生因子的释放,包括蛋白激酶RIOK1。
摘要部分
为了鉴定促进人类40S亚基最终成熟的新蛋白,作者通过质谱法表征了在RIOK1上的核糖体前亚基,并在捕获的因子中鉴定了去泛素化酶USP16。作者证明USP16构成晚期细胞质前40S亚基的一个组成部分,可促进从核糖体蛋白RPS27a/eS31的内部赖氨酸中去除泛素。USP16缺失导致晚期40S亚基成熟缺陷,表现为18S rRNA的不完全加工和迟发性核糖体生物发生因子的回收延迟,揭示了USP16对40S合成的最终步骤的贡献。最后,RPS27a的泛素化似乎依赖于主动翻译,表明40S成熟与蛋白质合成之间存在潜在联系。
研究内容
1.将USP16鉴定为前40S相关因子
在细胞质中40S核糖体亚基成熟的最后一步,18S-E前体rRNA被内切核酸酶NOB1加工成其成熟形式。为了鉴定与晚期细胞质40S亚基前体相关的人类40S核糖体亚基生物发生因子,作者通过StrepTactin亲和纯化C端Strep-HA(StHA)标记的激酶RIOK1分离了前40S颗粒。作者使用了RIOK1(kd)-StHA作为诱饵,并使用数据依赖采集通过质谱法分析各自的洗脱液。由于RIOK1也是在snRNP生物发生过程中甲基化Sm蛋白的甲基化体的一部分,甲基化体成分PRMT5和MEP50在RIOK1上得到了强烈的富集。虽然甲基小体复合物在WT和突变体RIOK1上的富集程度相似,但40S核糖体蛋白(RPs)和已知的40S反式作用因子DIM2、NOB1和TSR1优先与RIOK1(kd)颗粒分离。作者发现USP16最初被描述为组蛋白H2A的DUB,随后参与基因表达、细胞周期进程、分化和DNA损伤反应的调节。在这项研究中,作者决定关注USP16以研究其在40S亚基成熟中的潜在功能。
为了验证质谱获得的结果,作者重复了RIOK1-StHA Strep Tactin亲和纯化,并通过免疫印迹分析了洗脱液。实验表明USP16以及NOB1和40S核糖体蛋白RPS3/uS3在RIOK1(kd)-StHA诱饵上显着富集,证实了作者的MS分析。为了研究USP16是否也可以与其他40S相关因子共同纯化,作者接下来使用RPS2/uS5和40S反式作用因子ENP1和LTV1作为诱饵,与RIOK1(kd)相比。免疫印迹显示USP16在所有纯化的40S颗粒中的富集程度与NOB1相当,但在用作阴性对照的HASt标记的GFP的下拉中不存在。最后,作者确定了USP16在HEK293细胞提取物的蔗糖梯度中的沉降行为。与USP16与40S前颗粒相关的假设一致,USP16在40S峰组分中与LTV1、NOB1和RPS3/uS3共同迁移,但在60S峰和较重组分中均未富集。

研究结论:USP16是一个前40S相关因子。
2.USP16与晚期细胞质前40S核糖体相关
为了进一步表征USP16及其与40S的核糖体颗粒的关联,作者标记了WT USP16和催化失活的突变体,其中第205位的活性位点半胱氨酸突变为丝氨酸。作者将这些构建体转染到HeLa细胞中,并观察到USP16(WT)-和USP16(C205S)-StHA均定位于细胞质由于40S前的输出依赖于输出因子CRM1/XPO1,因此它们在被药物细霉素B抑制后在核质中积累。相比之下,在用LMB处理细胞后,USP16-StHA没有在细胞核中积累。接下来,作者生成了四环素诱导的HEK293细胞系,用于表达USP16(WT)-或USP16(C205S)-StHA,然后使用数据依赖采集进行质谱分析共同纯化蛋白质。有趣的是,作者鉴定了许多40SRP以及已知与细胞质前40S亚基相关的特征性40S反式作用因子。相比之下,只有少数已知与核前40S粒子或60S反式作用因子相关的40S反式作用因子被鉴定出来。
为了验证从质谱中获得的数据,作者对WT和突变体USP16-StHA进行了串联亲和纯化(TAP),并通过银染和免疫印迹分析了洗脱液。如晚期40S反式作用因子NOB1和40SRPRPS3/uS3的存在所示,这证实了40S前亚基与WT和突变体USP16-StHA共同纯化。60S反式作用因子RLP24和核糖体蛋白RPL23a/uL23的缺失进一步证实了USP16与40S前体特异性结合。值得注意的是,在洗脱液中也检测到小核糖体亚基蛋白RPS10/eS10。

研究结论:USP16相关40S颗粒中RPS10的存在表明USP16与对应于细胞质成熟非常晚期的前40S亚基的颗粒相关。
3.USP16的前40S关联取决于其ZnF-UBP结构域和USP结构域中的USP16特异性螺旋
USP16是泛素特异性蛋白酶(USP)家族的DUB。USP16除了其USP域外,还包含一个N端锌指泛素结合域(ZnF-UBP)域。为了阐明40S结合需要USP16的哪些结构域,作者生成了C端StHA标记的USP16截断结构,其中仅包含ZnF-UBP结构域或USP结构域。作者分析了这些截断结构在瞬时转染到HeLa细胞后的定位。USP、DH和USPDH片段都像WT USP16-StHA一样位于细胞质中。为了直接解决USP16的哪些部分有助于40S结合,作者从可诱导表达突变构建体的HEK293细胞中进行了TAP,并通过银染色和免疫印迹分析了共同纯化的蛋白质。前40S亚基与USP结构域的结合受到严重损害,并且通过银染和免疫印迹只能检测到非常低的水平。此外,与全长USP16相比,USP16特异性基本螺旋(DH)的缺失不会改变与pre-40S亚基的结合。然而,在删除基本螺旋后,孤立的USP域的弱40S关联完全丢失。

研究结论:主要是ZnF结构域以及USP结构域内带正电的螺旋与前40S结合。
4.USP16的缺失导致修饰的RPS27a的积累
确定USP16与前40S亚基结合后,作者试图深入了解潜在的核糖体相关功能,这可能需要对USP16底物进行去泛素化。40S亚基的几个RP与泛素化相关,因此是候选USP16底物。为了评估USP16是否可能参与从这些候选RP中去除Ub,作者通过RNAi敲低USP16后的免疫印迹评估了它们的修饰。有趣的是,用siRNA敲低USP16会导致出现更高分子量的RPS27a条带。为了验证USP16敲低的特异性,作者使用靶向USP16 mRNA 3'UTR的siRNA在诱导表达WT或催化失活USP16-StHA的HEK293细胞系中进行了RNAi回补实验。如前所述,在亲本HEK293细胞或未诱导的USP16细胞系中敲低USP16导致出现更高分子量的RPS27a带。重要的是,这可以通过WT而不是突变体USP16的表达来恢复,表明USP16的催化活性是去除RPS27a修饰所必需的。有趣的是,即使存在内源性USP16,突变体USP16的StrepTactin亲和纯化也共同纯化了修饰的RPS27a,这表明无催化活性的USP16在去除RPS27a修饰时以负方式起作用。为了进一步证实在USP16敲低时观察到的RPS27a修饰,作者在HeLa和HEK293细胞系中使用CRISPR/Cas9系统生成USP16敲除(KO)细胞系。HeLa和HEK293细胞系中的USP16 KO验证了在USP16缺失后观察到的RPS27a修饰的增加。重要的是,在HEK293 USP16 KO背景中,四环素诱导的WT表达而不是突变体USP16-StHA可以回补USP16 KO并导致修饰的RPS27a减少。

研究结论:USP16的缺失导致修饰的RPS27a的积累。
5.在USP16缺失后,RPS27a在赖氨酸113上被跨泛素化
为了研究在USP16敲低或敲除时观察到的修饰带是否对应于单泛素化RPS27a,作者通过免疫沉淀(IP)来富集RPS27a。然后进行RPS27a和Ub的免疫印迹。结果发现修饰的RPS27a带与Ub带的重叠,表明USP16的敲低导致RPS27a单泛素化形式的积累。靶蛋白的多泛素化通常与随后的蛋白酶体降解有关,而单泛素化被认为具有非蛋白水解的调节作用。一致地,用MG132抑制蛋白酶体会导致多泛素化靶蛋白的增加,但会导致调节性单泛素化丢失。用MG132处理USP16 KO细胞确实导致修饰的RPS27a显着减少,暗示RPS27a单泛素化的调节作用。作者假设观察到的RPS27a泛素化不对应线性前体融合蛋白,而是RPS27a在内部的泛素化反式赖氨酸(Lys)。来自不同真核生物的40S亚单位的高分辨率结构意味着RPS27a内的几个Lys残基与18S rRNA骨架协调。然而,七个赖氨酸残基(K89、K90、K96、K99、K107、K113、K152)暴露在溶剂中,不直接参与rRNA结合。因此,作者将这些氨基酸突变为精氨酸以测试这是否会在USP16敲低时消除RPS27a泛素化。当在表达带有这些突变的C端StHA标记的RPS27a构建体的细胞系中敲低USP16时,不再观察到泛素化,而WT构建体仍然被修改。为了查明准确的修饰位点,作者分别将突变的残基恢复为Lys,并观察到当重新引入Lys113时泛素化重新建立。作者通过将Lys113突变为Arg确认为唯一的修饰位点,这确实在USP16敲低后消除了RPS27a泛素化。

研究结论:USP16作为RPS27a的DUB,在Lys113上进行反式单泛素化。
6.USP16缺失影响40S亚基组装的后期阶段
基于作者观察到USP16与细胞质前40S亚基相关并且泛素化的RPS27a与USP16(C205S)突变体共同纯化,作者认为USP16介导的RPS27a去泛素化可能在40S成熟后期起作用。为了验证这一假设,作者首先使用与18S rRNA前体的5'ITS1区杂交探针,通过Northern印迹法分析了rRNA前体的处理。作者还观察到USP16 KO细胞中18S-ErRNA前体的显着增加表明USP16缺失影响了18S rRNA加工的最后一步,该加工由内切核酸酶催化细胞质中的NOB1。
作者接下来分析了40S反式作用因子稳态定位的潜在变化。ENP1和DIM2在稳定状态定位于细胞核,但这两个因子都伴随着前40S亚基进入细胞质,在那里它们从成熟的亚基中释放出来并循环回细胞核。虽然ENP1的定位在HeLa USP16 KO细胞中没有受到影响,但DIM2部分重新定位到细胞质中,表明细胞质40S成熟缺陷不影响ENP1的释放,但DIM2从细胞质中的40S亚单位释放。重要的是,瞬时转染的WT但不是突变体USP16-StHA的表达挽救了40s的生物发生缺陷并恢复了DIM2的核定位。内切核酸酶NOB1也是极少数与由RIOK1(kd)分离的晚期pre-40S颗粒相关的非核糖体蛋白之一。NOB1和RIOK1在LMB处理的USP16 KO细胞中都显示出增强的细胞质定位,表明它们从细胞质前40S亚基中的释放受到抑制。

研究结论:USP16缺失仅影响细胞质前40S成熟的晚期阶段,即ENP1释放之后以及DIM2、NOB1和RIOK1释放之前或期间。
7.抑制翻译后RPS27a泛素化减少
作者用放线菌素D处理特异性抑制RNA聚合酶I,从而阻断核糖体组装。然而,这并没有导致泛素化RPS27a水平的变化,这可能表明具有单泛素化RPS27a的前40S亚基具有低周转率。随后作者测试了USP16 KO和RPS27a泛素化是否也会影响翻译。作者首先通过蔗糖梯度离心检查泛素化RPS27a是否仅存在于40S池中。有趣的是,作者泛素化的RPS27a与其未修饰的形式一样,在含有40S亚基、80S核糖体和多聚体的部分中发现的程度相同,这表明RPS27a在前40S亚基上的泛素化不会阻碍它们与mRNA结合并进入翻译核糖体库。
接下来,为了直接检查翻译是否受到影响,作者对HeLa WT和USP16 KO细胞进行了polysome轮廓分析。正如预期,USP16的缺失导致40S生物发生缺陷。先前的研究表明,可以在多核糖体组分中检测到前40S亚基。这些前40S粒子是否异常、过早进入翻译过程或接受强制性的翻译起始依赖质量控制检查仍然难以捉摸。作者研究了翻译的抑制是否也会导致RPS27a泛素化的变化。WT和USP16 KO细胞用CHX、翻译起始抑制剂silvestrol或DTT处理,这会导致未折叠蛋白反应的诱导,从而导致通过eIF2a的磷酸化启动翻译,然后通过免疫印迹分析。虽然在处理WT细胞后没有观察到任何变化,但在用CHX处理或通过silvestrol或DTT抑制翻译起始后,USP16 KO细胞中泛素化RPS27a的水平显着降低,表明RPS27a泛素化依赖于主动翻译。G418与核糖体的解码中心结合并诱导A位点错误编码,从而在蛋白质合成过程中降低翻译保真度并促进错义发生。有趣的是,当作者用G418处理细胞时,作者观察到HeLa USP16 KO细胞中泛素化RPS27a的水平显着增加。这表明G418与解码位点的结合可能诱导易于RPS27a泛素化的核糖体的翻译状态,或稳定已经泛素化的前40S亚单位。
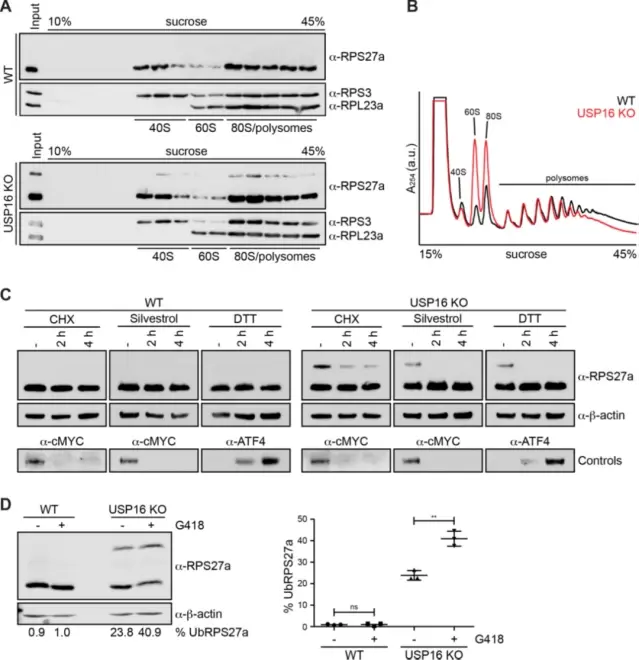
研究结论:RPS27a泛素化通过干扰mRNA翻译而改变。
结论与讨论
为了发现参与前40S亚基成熟最后阶段的新因素,作者从人类细胞中分离了40S晚期前体,并通过质谱法鉴定了相关蛋白质,其中包括去泛素化酶USP16,先前显示其参与组蛋白H2A的去泛素化。作者分析表明USP16是晚期细胞质前4OS颗粒的组成部分,并且其缺失会影响4OS成熟的最后阶段。此外,USP16的缺失导致单泛素化40S核糖体蛋白RPS27aleS31的积累。最后,数据表明RPS27a泛素化依赖于主动翻译,暗示了40S成熟和翻译的最后阶段之间的潜在联系。
Thank you!
原文链接:https://elifesciences.org/articles/54435

