高中化学基础与解法全集(涵盖所有)|长期更新|从零开始拯救所有学渣!

(来看一看?会更新)
有机化学
基础知识:烃类就是只含C、H两种元素。
饱和烃:全部含C—C单键。




取代反应:有进有出,产物混合。

标况下,CHCl3是气体。


碳碳双键可发生的反应:加 加 氧


化学第一题选择题可能会出现

聚丙烯是口罩的熔喷布。

▪有机高分子材料:聚xxx;xxx树脂;xxx沦。
记:
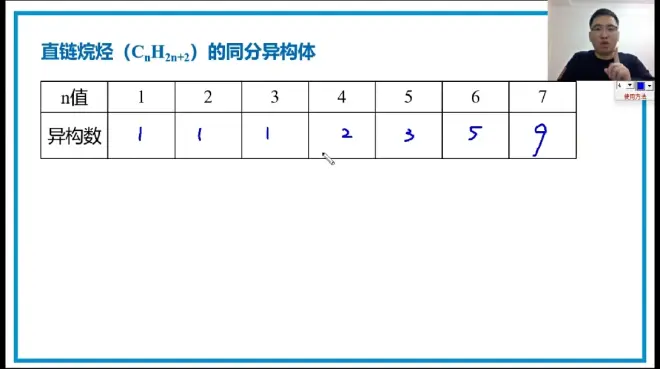


链状烷烃的二卤代物 同分异构体:
树状分裂法:


乙醇:能与水以任意比例互溶。(因为乙醇可以与H2O形成氢键)
沸点:78℃。
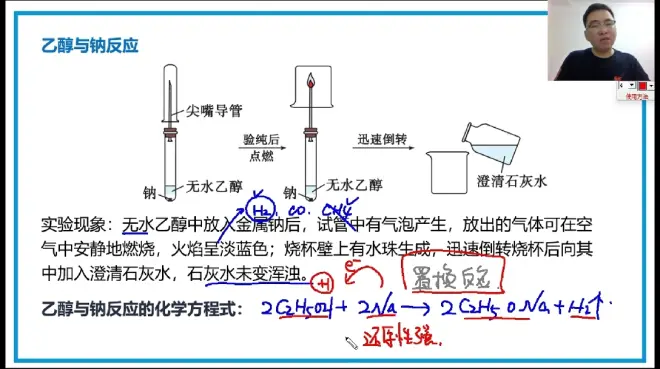


※乙醇:加氧/去H=>氧化反应。
去氧/加H=>还原反应。

C2H5OH可以使KMnO4(H+)褪色,也可以使K2CrO7(H+)变色。

乙酸
甲酸=蚁酸(HCOOH); 乙酸=醋酸

能与碳酸钠/碳酸氢钠反应,且能产生CO2的只有--COOH。

※都是浓硫酸后加

先:下层液体下层出。后:上层液体上层出。
分液:两互不相容液体。


——————————————————————————
氧化还原反应



口诀来了——↓

第一步就是看它们的化合价
———————————————————————————
硫及其化合物


(2)现象:有蓝紫色火焰。

C、Fe被氧化成Fe²⁺

红字:70%——↑ ▪H₂SO₃受热易分解成SO₂和H₂O(上述图中反应放热,所以H₂SO₃被分解)


蓝字:2SO₂——↑



A、模糊不清

▪少量定为一


▪注意:二氧化硫和水的反应是可逆反应,三氧化硫和水的反应却不是

▪但SO₂不与浓H₂SO₄反应

▪现象:出现黄色混浊,证明SO₂的氧化性。


硫酸根离子的检验:

先加稀HCI的目的是:排除干扰因素。
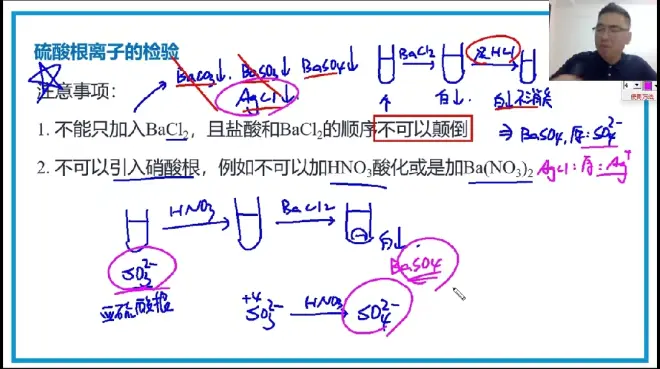
2、蓝字部分已说明原因。假设溶液中一开始只有SO₃²⁻,但你加入了NO₃⁻,SO₃²⁻能与NO₃⁻反应生成SO₄²⁻,这个SO₄²⁻是制造出来的,并不是原本溶液有的。

AD、因为引入了NO₃⁻,无法证明Na₂SO₃是否被氧化
B、如果SO₃²⁻没有被氧化,就不会含有SO₄²⁻
▪NO₃⁻(H⁺)具有氧化性

▪气体Br₂(橙黄色) I₂(黄色)
▪还原性强优先被氧化
▪还原性顺序:留点铁锈绿锰哥

②、CO₂(CO₂+H₂O=H₂CO₃) 氯气也可以
③、氯气具有强氧化性,也能使品红溶液褪色,但加热不能使品红溶液恢复原色
④、看图中对应的蓝字
⑤、能使溴水褪色是带有还原性气体,CO₂和SO₃属于最高化合价,不能是其褪色
⑥、O₂、CI₂也可以
▪H₂S(黄色)
▪褪色(被还原)

▪SO₂能与NO₃⁻反应生成SO₄²⁻
▪CO₂与Ca(OH)₂生成CaCO₃;SO₂与Ca(OH)₂生成CaSO₃


C、看图
D、少量SO₂生成的是亚硫酸氨,除非你过量再通入SO₂,才能生成NH₄HSO₃

6、没有稳定的中间价态
氮及其化合物

▪Mg不仅能与O₂反应,还能与N₂反应







相对分子质量:NH₃=17 空气=28.8所以相对分子质量小的,在同温同压下,密度也比较小。


粉字部分:氧化物 对应水化物 盐


▪HCIO光照或加热也会分解

▪(1)口诀:煽(3)爸(8)煽(3)儿(2)子(4)
▪钝化3条件:Fe or AI+常温+浓HNO₃or浓H₂SO₄
▪Cu与浓H₂SO₄,常温下不反应(正所谓“不浓不热不反应”)

▪浓硝酸滴加在紫色石蕊试液上,先变红,后褪色,因为浓硝酸的氧化性很强



▪把NH₃·H₂O中NH₃逼出来的方法:①NH₃·H₂O受热会分解成NH₃;②温度越高,气体溶解性越低。

▪不能用NaOH替代Ca(OH)₂ 因为NaOH碱性太强,玻璃耐酸不耐碱,它会和NaOH发生反应

▪P₂O₅能与H₂O反应,生成PO₄³⁻
▪第一个漏斗的名称:倒扣漏斗
无机非金属材料

粘土——↑

石英砂——↑

石灰石:玻璃、水泥——↑

