元素简介:锂

大家好,今天了解一下锂,原创资料希望喜欢,锂相对氢和氦来说比较简单,不涉及量子力学,而涉及一些有机化学知识。
锂是是一种金属元素,元素符号为Li,原子序数为3。在标准状况下,锂是一种质软,银白色的碱金属。锂是最轻的金属,也是最轻的固体元素。
1. 特性:
①物理特性:
同其他碱金属一样,锂具有单价电子,锂很容易失去这个电子而形成阳离子。由于锂的价电子过于接近它的原子核,锂有着碱金属中最低的活性,但锂依然有良好的导热和导电性。
锂质软,可以用小刀切割。锂被切割开时,会显现出银白色,但空气会将锂迅速氧化变成灰色。虽然锂的熔点在金属金属中相对较低,但锂依然是碱金属中熔沸点最高的。
锂的密度非常低(0.534g/cm3),与松木相当。在室温下为固体的所有元素中,锂有着最小的密度;其次为钾(0.862g/cm³)。此外,除了氢和氦之外,锂的密度比任何元素的液态都小,只有液氮密度(0.808g/cm³)的三分之二。锂、钠、钾都可以漂浮在水上,锂甚至可以漂浮在最轻的烃类油表面。
锂的热膨胀系数几乎是铝的两倍,铁的四倍。锂在在常压400μK以下或20GPa以上会具有超导性。在低于70K的温度下,锂与钠一样,会经历无扩散相变。在4.2K时,锂会转变为菱形六方晶系(具有九层重复间隔);如果将温度升高,锂会转变为面心立方晶系,继续升高还会转为体心立方晶系。在高压下锂有多种同素异形体。
锂的质量比热容是3.58kJ/kg·K,是固体中最高的。因此,金属锂常在导热应用中用于冷却剂。
②常见化学性质:
锂很容易与水反应,但比起其他碱金属,锂的活性明显降低。锂与水会生成氢氧化锂和氢气。虽然其他碱金属可以储存在煤油中,但锂的密度过低,通常储存在更轻的石蜡油中。在潮湿的空气中,锂迅速变色,形成氢氧化锂、氮化锂和碳酸锂的黑色混合涂层。
当锂化合物置于火焰上时,会发出醒目的深红色,当它强烈燃烧时,火焰就会变成更加明亮的银白色。锂是易燃的,当锂暴露在潮湿空气中,尤其是暴露在水中时,锂可能会发生爆炸,但其他碱金属相比锂会更加剧烈。锂是少数几种可在通常状况下与氮发生反应的金属之一。与所有碱金属一样,锂燃烧产生的火焰很难扑灭,需要使用特殊的D类干粉灭火器。
由于对角线规则,锂和镁有着相似的原子半径和离子半径。这两种金属都可以与氮气反应生成氮化物,并且在氧气中燃烧时都可形成氧化物和过氧化物。此外,锂和镁的盐类都有着相似的溶解度,碳酸盐及氮化物也都有热不稳定性。
已知其他的二元化合物包括卤化物、硫化物、超氧化物和碳化物(Li₂C₂)等等。锂与其他阴离子可结合形成各种盐类,如硼酸盐、氨基盐、碳酸盐、硝酸盐或硼氢化物等。锂的铝氢化物广泛在有机合成中用作强还原剂。
氦化锂(LiHe)是一种弱相互作用的范德华分子,只有在极低温度下才存在。
③有机化学:
在有机化学中,碳原子可以和锂原子直接成键,从而形成碳离子,它们是亲核试剂,同时也是强碱。因此有机锂试剂会广泛在医药工业中用作不对称合成。在许多有机锂化合物中,锂离子会同其他碱性阳离子一样聚集形成高对称性团簇。这些试剂有着强反应性,反应时会生成大量热量。
Ⅰ:作为亲核试剂
碳锂化反应:
作为亲核试剂,有机锂试剂的碳-锂键会越过碳-碳双键或三键并使其加成,而锂原子则与另一端结合形成新的有机锂化合物,这种反应称为碳锂化反应。该反应是有机锂化合物应用最广泛的反应。碳锂化反应在阴离子聚合过程中非常重要,因此丁基锂可用作苯乙烯、丁二烯、异戊二烯或其混合物的聚合催化剂。

利用这种反应性的另一个应用是通过分子内碳锂化形成碳环和杂环偶联物。作为阴离子环化的一种形式,分子内碳环化相比自由基环化有许多优点。首先,产物的环状有机锂物种可与亲电试剂反应相对容易分离,而捕获自由基的中间体通常是相当困难的。其次,阴离子环化通常比自由基环化具有更广泛的区域性和立体特异性,特别是在5-己烯基锂的情况下。烷基或乙烯基锂可以通过分子内碳化加成三键和单烷基从而取代双键。如果形成五元环,芳基锂也可进行加成。但分子内碳化难以形成三元或四元环,因为中间产物的环状有机锂化合物往往会经历开环反应。下图为分子内碳锂化反应的实例。锂原子与卤素原子发生交换,衍生的锂化合物通过5-外环封闭循环形成乙烯基锂。乙烯基锂进一步与亲电试剂反应并产生环戊基化合物。

羰基加成:
有机锂试剂作为亲核试剂可以与亲电的羰基双键加成以形成碳-碳键。它们可以与醛和酮反应生成醇类。加成主要为极性加成,其中亲核有机锂化合物从水平方向攻击原子,并在竖直方向产生醇类的碳碳键。添加如高氯酸锂之类的锂盐可以提高反应的立体选择性。

当酮受到空间位阻时,格氏试剂常常导致羰基的还原而不是加成。而烷基锂试剂一般则不会还原酮,因此有机锂试剂可用于合成取代醇。下图是乙基锂与金刚烷酮反应来生产叔醇。

有机锂试剂与羧酸反应生成酮的能力也优于格氏试剂。通过控制有机锂试剂的添加量,或者使用三甲基氯硅烷清除过量的锂试剂,可以提高与羧酸反应效率。合成酮的另一种更普遍的方法是有机锂试剂与温勒伯酰胺(N-甲氧基-N-甲基酰胺)反应,这个过程叫温勒伯酮合成。当过量使用有机锂试剂时,由于N-甲氧基氧和羰基氧之间的锂离子螯合,羰基氧会形成四面体中间体,并在酸性加成时发生塌陷,从而得到产物。

有机锂试剂也可以与二氧化碳反应形成羧酸。
有机锂化合物也可以烯酮发生反应,并存在两个亲核加成位点(1,2加成到羰基碳或1,4共轭加成到添加到β碳),大多数有机锂化合物倾向于1,2加成,但也仍存在一些方法可以使有机锂试剂更易进行共轭加成。首先,由于1,4加成产物在热力学上可能是更有利的物质,因此可以通过两种产物的异构化平衡实现共轭加成,特别是当锂亲核试剂较弱且1,2加成是可逆时。另外,向反应中加入供体配体形成杂原子稳定的锂物质也有利于1,4共轭加成。如向溶剂中加入低浓度的HPMA[N-(2-羟丙基)甲基丙烯酰胺]有利于1,4加成。在没有供体配体的情况下,锂阳离子会与氧原子紧密配位,而当锂阳离子溶于HPMA时,羰基氧和锂离子之间的配位会被削弱。但该方法通常不会影响烷基和芳基锂试剂的区域选择性。

有机锂试剂也可以在手性配体存在下对羰基及其衍生物进行对映选择性亲核加成。该反应性广泛应用于药物化合物的工业合成中。例如默克公司和杜邦公司合成的药物依法韦仑,这是一种有效的HIV逆转录酶抑制剂。将乙炔基锂加入前手性酮中,就会得到手性醇产物。该反应的活性中间体的结构经NMR光谱和固态的X射线晶体扫描后确定为立方2:2四聚体。

SN2反应:
有机锂试剂可作为亲核试剂,与烷基或烯丙基卤化物进行SN2型反应。虽然在烷基化反应中有机锂试剂比格氏试剂有着更强的反应性,但由于诸如自由基反应或金属-卤素交换反应等竞争性副反应,有机锂试剂的使用仍然受到限制。在烷基化反应中使用的有机锂试剂一般有着更低的碱性和聚集性,并且更加稳定。例如含杂原子的稳定锂试剂、芳基锂或烯丙基锂等等。HMPA[N-(2-羟丙基)甲基丙烯酰胺]可以提高反应速率和产物产率,而添加醇酸钾也可增强芳基锂的反应性。有机锂试剂也可以用环氧化物进行亲核攻击以形成醇。

Ⅱ:作为碱
有机锂试剂广泛具有碱性。叔丁基锂含有碳负离子,对质子有极强的结合能力,是常见的最强的碱之一(pKa=53)。因此,在有机锂试剂存在下,-OH、-NH和-SH上的质子需要受到保护。一些常用的有机锂碱类是烷基锂,如丁基锂和二烷基酰胺锂。含有大量R基团的试剂,如二异丙基酰胺锂(LDA)和二(三甲基硅基)氨基锂(LiHMDS)常常在亲核加成中受到空间位阻影响,因此在去质子化时更具选择性。二烷基酰胺锂(LiNR2)广泛用于烯醇盐的形成和羟醛缩合反应。这些碱的反应性和选择性也会受到溶剂和其他离子的影响。
金属化:
有机化合物分子中的氢被金属取代,生成含有碳-金属键的有机金属化合物的反应叫作金属化反应。如果发生反应的是有机锂试剂(最常见的是烷基锂)并形成新的有机锂物质时,则被称为锂化反应或锂-氢交换反应。

常见的金属化试剂是丁基锂。叔丁基锂和仲丁基锂通常比正丁基锂和异丁基锂有着更好的反应性和选择性,但是它们也更昂贵且难以处理。金属化是制备多种有机锂试剂的常用方法。金属化的位置主要受C-H键的酸度影响。锂化通常发生在吸电子的α基团的位置,因为这样可以稳定阴离子的电子密度。此外,芳香族化合物和杂环化合物上也存在定向基团来提供了区域选择性的金属化位点,定向的邻位金属化是金属化种一类很重要的反应。金属化的砜类,酰基及α-酰胺是化学合成中的重要中间体。通过烷基锂进行金属化的烯丙基醚或LDA(二异丙基酰胺锂)金属化形成的α阴离子氧可以发生2,3-维蒂希重排反应。添加供体配体如TMEDA(四甲基乙二胺)和HMPA[N-(2-羟丙基)甲基丙烯酰胺]可以提高金属化率并扩大底物范围。通过不对称金属化也可获得手性有机锂试剂。
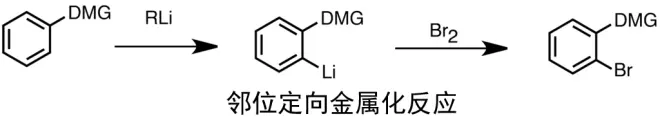
邻位定向金属化反应是合成区域特异性取代芳烃化合物的重要手段。由于有机锂试剂的高区域选择性,这种利用亲电性进行中间锂化物的锂化并随后淬灭的方法通常比直接进行亲电性芳香取代方法更加高效稳定。该反应通过芳环上位于α位置上的有机锂试剂与定向金属化基团(DMG)进行脱位。DMG通常是一个含有杂原子的官能团,该杂原子为路易斯碱,并且可以与作为路易斯酸的锂离子进行配位。这产生了复合诱导邻近效应,该效应使得α位置上的去离子化分子形成了能进一步与亲电体反应的芳基锂化合物。酰胺、氨基甲酸酯、砜和磺酰胺是常见的定向金属化基团。这些基团是强力的吸电子基团,可增加芳香环上α位置上的氢的酸性。当有两种定向金属化基团存在的情况下,虽然还会观测到混合产物,但金属化通常与较强的导向基团相连接。许多含有酸性质子的杂环也可以进行正金属化。然而,对于缺乏的电子杂环化合物,则需要使用诸如LDA(二异丙基氨基锂)之类的锂酰碱,因为烷基锂对缺电子杂环进行的是加成而不是去离子化。而某些过渡金属的芳烃络合物也能帮助完成金属化,常见的有二茂铁,这是因为过渡金属会从芳烃中吸引电子,从而使芳香烃的酸性变强,进而完成正金属化。
超强碱:
在烷基锂中加入醇钾可以******锂的碱度。向丁基锂里加入叔丁醇钾可以形成超强碱,通常缩写为“LiCKOR”试剂。这类超强碱具有高度活性,并可作为立体选择剂。在下面的示例中,LiCKOR碱通过金属化和随后的锂-非金属交换产生立体特异性的巴豆基硼酸酯类物质。

不对称的金属化:
通过前手性底物的不对称金属化可以获得对映体富集的有机锂化合物。不对称异构诱导需要存在手性配体,例如(-)-鹰爪豆碱。手性有机锂化合物的对映体比率通常受去质子化速率的影响而不同。在下面的实例中,在(-)-鹰爪豆碱存在下用正丁基锂处理N-叔丁氧羰基-N-苄胺,可得到需要的对映体。用三甲基氯化锡的金属转移反应得到相反的对映体。

烯醇化物形成:
锂烯醇化物是有机锂物质将α位置的C-H键去羰基化而形成的。锂烯醇化物作为亲核试剂广泛应用于醛醇缩合和烷基化等碳-碳键形成反应中。它们也是形成烯醇硅醚的重要中间体。

锂烯醇化物的形成可以理解为酸碱反应,其中α羰基结构[在DMSO(二甲基亚砜)中pK=20-28]可作为酸性的质子与作为碱的有机锂化合物反应。一般使用碱性的有机锂试剂为强力非亲核试剂,如LDA(二异丙基氨基锂)、LiHMDS[二(三甲基硅基)氨基锂]或LiTMP(四甲基**锂)等锂酰胺类物质。THF(四氢呋喃)和DMSO(二甲基亚砜)是锂烯醇反应中的常用溶剂。
烯醇化物的形成机理和立体结构引起了化学界的极大兴趣。烯醇化物形成的立体结构由多种因素影响,如空间效应,溶剂类型,极性添加剂的使用及碱性有机锂化合物的类型。目前已有多种模型用于解释和预测锂烯醇化合物的立体结构及其选择性。而爱尔兰模型则是最常见的之一。
在该假设中,单体LDA(二异丙基氨基锂)与羰基底物反应并形成循环型的Zimmerman-Traxler过渡态。由于(Z)-烯醇化物过渡态因顺式戊烷干扰作用而不利于生成,因此(E)-烯醇化物相对更易生成。

添加极性添加剂如HMPA[N-(2-羟丙基)甲基丙烯酰胺]或DMPU(1,3-二甲基丙撑脲)有利于(Z)烯醇化物的形成。爱尔兰模型认为这些供体配体可与锂阳离子配位,导致了羰基氧和锂的相互作用减少,并使得过渡态不像六元椅式结构那样有着紧密的结合能力。当使用拥有较大侧链的锂碱,如二(三甲基硅基)氨基锂[LiHMDS]时,(Z)-烯醇化物的百分比也会增加。然而,这些添加剂如何影响立体选择性的机制仍在争论中。
爱尔兰模型存在一些挑战,因为它描述了有机锂化合物作为过渡态的单体。实际上,在锂烯醇化物溶液中经常观察到各种锂聚集体,并且具体聚集情况取决于原始反应物,溶剂和反应条件,很难以确定哪种聚集体是溶液中的实际活性物质。
Ⅲ:锂-卤素交换
锂-卤素交换是有机卤化物和有机锂化合物之间的复分解反应。吉尔曼和维蒂希在20世纪30年代末独立地发现了这种方法。

锂-卤素交换的机制仍有争议。反应中可能产生可逆的酸根型配合物中间体,这种中间具有亲核效应导致了反应发生。法纳姆和卡拉布雷塞分离出与TMEDA(四甲基乙二胺)复合的酸根型配合物——双(五氟苯基)碘化锂,并观测了其X射线晶体结构。酸根型配合物进一步与亲电子试剂反应并形成五氟苯基碘化物和苯基锂。许多动力学研究也与该亲核途径相一致,其中有机锂化合物上的碳阴离子攻击芳基卤上的卤素原子。另一种可能的机制涉及单电子转移和自由基的产生。在仲烷基锂、叔烷基锂和烷基卤化物的反应中,通过电子自旋共振光谱可以检测到自由基的存在。然而,目前仍无法确定这些基团是否是反应中间体。锂-卤素交换的机理研究也因有机锂化合物聚集体的形成而变得复杂。
锂-卤素交换的速度非常快。它通常比常见的亲核加成更快,有时甚至可超过质子转移的速率。在下面的例子中,有机锂化合物和伯碘化物之间的交换几乎瞬间完成,反应速度超过了从甲醇到叔丁基锂的质子转移。主要烯烃产物的收率超过了90%。

锂-卤素交换在制备新的有机锂试剂中非常有用。交换速率通常遵循以下趋势I>Br>Cl。烷基和芳基氟化物通常不与有机锂试剂起反应。锂-卤素交换受动力学控制,交换速率主要受有机锂试剂的碳阴离子中间体(sp>sp2>sp3)的稳定性影响。例如,碱性的更强的叔碳位机锂试剂是有着更强的反应性,可与伯烷基卤化物(通常是溴化物或碘化物)反应以形成更稳定的有机锂化物。因此,锂-卤素交换常用于制备乙烯基、芳基和伯烷基锂试剂。烷氧基或杂原子可以稳定碳阴离子时,促进锂和卤素发生交换。该方法尤其适用于制备那些在苛刻条件下不能被锂还原的试剂。如乙烯基卤化物通常会进行锂-卤素交换,用于保留双键以制备各种异构产物。

以下是在合成口马口非中使用锂-卤素交换的实例。反应过程中正丁基锂与溴化物进行锂-卤素交换。亲核碳阴离子中心快速从碳酰化到双键,生成了一个由邻近的砜基稳定的阴离子。由阴离子引起的分子内SN2反应形成口马口非的环骨架。

锂-卤素交换是Parham环化反应的关键部分。在该反应中,芳基卤化物(通常为碘化物或溴化物)与有机锂化物交换以形成芳烃锂化物。如果芳烃带有亲电部分的侧链,则与锂相连的碳阴离子将进行分子内亲核环化。该反应可用于形成杂环。在下面的实施例中,Parham环化用于异氰酸酯的环化以形成异吲哚啉酮,然后将其转化为硝酮。硝酮类物质会进一步与自由基反应,并可用作“自旋陷阱”以研究生物自由基过程。

Ⅳ:转移金属化
有机锂试剂可通过金属转移法制备其他有机金属化合物。有机铜,有机锡,有机硅,有机硼,有机磷,有机铈和有机硫化合物通常通过使有机锂试剂与适当的亲电试剂反应来制备。

常见的锂金属转移包括锂/锡,锂/汞和锂/碲交换,它们可在低温下快速反应。锂/锡交换的优点在于三烷基锡烷前体很少经历副反应,所得的产物通常不与烷基锂试剂反应。在以下实施例中,由末端炔烃合成的乙烯基锡类物质通过与正丁基锂的金属转移反应形成乙烯基锂。

有机锂也可用于通过锌盐的金属转移反应制备有机锌化合物。

二铜酸锂有机物可以通过使烷基锂物质与卤化亚铜反应而形成。与有机锂试剂或格氏试剂相比,所得有机铜酸盐对醛和酮的反应性相对较低。

④同位素:
锂由两种天然存在的稳定同位素,分别是锂-6和锂-7组成,其中锂-7有着较高的丰度。

与周期表中相邻的氦和铍相比,锂-6和锂-7都具有异常低的核结合能。锂是唯一通过核裂变产生的轻元素。除了氘和氦-3之外,锂-6和锂-7的平均结合能比任何其他稳定的核素都低。因此,虽然锂有着很低的原子数,但锂在太阳系中锂并不像其他轻元素那么常见。除了稳定的锂-6和锂-7外,锂还存在7种放射性同位素,其中最稳定的是半衰期为838ms的锂-8和半衰期为178ms的锂-9,锂的其他放射性同位素的半衰期均小于8.6ms,半衰期最短的是锂-4,锂-4会产生质子发射衰变,半衰期仅有7.6×10⁻²³秒。
锂-7是大爆炸核合成中产生的原始核素之一。由于在恒星核合成中,锂的产生速度和消耗速度差不多,因此只有少量的锂-6和锂-7是在恒星中产生。太阳风和宇宙射线与较重的原子作用以及早期太阳系铍-7和铍-10的衰变可产生另外少量的锂。在碳星中也有着少量的锂。
两种稳定的锂同位素都可以被激光冷却用于产生第一种量子简并玻色-费米混合物。
2.分布
虽然锂是在大爆炸时期合成的,但是锂(连同铍和硼)在宇宙中的含量明显少于其他元素。这是由于在恒星中燃烧锂所需的温度相对较低,而锂又不容易生成。
根据现代宇宙学理论,锂(锂-6和锂-7)是大爆炸中合成的三种元素之一。虽然在大爆炸核合成中产生的锂量取决于每个重子的光子数,但是锂的丰度应该是可以推算的。老年恒星的锂含量较少,而年轻恒星的锂含量则要多得多。老年恒星锂的缺乏主要是锂在恒星内部被迅速消耗而缓慢生成,而年轻恒星则可较快的产生锂。另外,尽管锂在240万摄氏度(大多数恒星在其内部很容易达到这个温度)以上会与质子碰撞而转变成两个氦原子,但在下一代恒星中锂的含量仍比预测的要多。
锂也存在于棕矮星等亚恒星天体和某些异常的橙色恒星中。由于锂可存于棕矮星,而在红矮星中会被破坏,因此可对恒星光谱进行锂测试可以方便二者区分。某些橙色恒星也可能含有高含量的锂,这些橙色恒星大部分都是含有中子星或黑洞等大质量星体的双星系统,大质量星体的引力会将较重的锂从氢和氦层拉致恒星表面,从而导致更多的锂被观测到,如半人马座X-4。
在许多植物,浮游生物和无脊椎动物中体内也发现有微量的锂,浓度为十亿分之69到5760。而在脊椎动物中,锂的浓度略低,只占十亿分之21至763。海洋生物往往比陆地生物体内有着更高的锂含量。但锂是否有生理作用目前尚不清楚。
3.应用
①陶瓷和玻璃
氧化锂可降低材料的熔点和粘度并改善热膨胀系数,因此广泛用于处理二氧化硅的助熔剂。这是锂化合物最大的用途之一。含有氧化锂的玻璃可用于制造烤箱。碳酸锂也可同样用于此,因此碳酸锂在加热时转化为氧化锂。
②电气与电子工程
20世纪末,锂因为其高电极电势而成为电池电解质和电极的重要组成部分。由于锂的低原子量,所以锂有着很高的电荷和功率重量比。含锂的电池通常包括锂电池、锂离子聚合物电池、磷酸铁锂电池和纳米线电池。其中应用最广泛的当属锂离子电池,锂离子电池每单元可产生大约3伏特的电压,而铅酸电池为2.1伏特,锌碳电池只有1.5伏特。锂离子电池可循环充电并且有很高的能量密度。
③润滑脂
锂的还有一种常用的用途是作为润滑脂。氢氧化锂是一种强碱,当用脂肪加热时,会生成硬脂酸锂。硬脂酸锂具有增稠增油的能力,用于制造高温润滑脂。
④冶金
碳酸锂可用作连铸结晶器保护渣的添加剂,用于提高其流动性。锂化合物还用作铸铁铸造砂的助熔剂,以减少震动。
氟化锂可被用作铝冶炼厂通过霍尔-海洛尔工艺提炼铝的添加剂,用于降低熔化温度和提高电阻。
锂在焊接或焊接助焊时可促进金属的熔化并消除氧化物。锂与铝、镉、铜和锰的合金用于制造高性能的飞机零件。
⑤硅纳米焊接
在电池等电子元件中的硅纳米焊接中,锂能有效维持焊接缝隙。
⑥其他化学和工业用途
烟火:
锂化合物可用作烟火着色剂和红色焰火的氧化剂。
空气净化:
氯化锂和溴化锂具有吸水性,可用作气流的干燥剂。氢氧化锂和过氧化锂则在航天器和潜艇中用于去除二氧化碳和空气净化。这是因为氢氧化锂可与二氧化碳反应,并且由于其重量低而优于其他碱性氢氧化物。而过氧化锂不仅与二氧化碳反应而且还能释放氧气。
光学:
人造的晶体氟化锂是透明的,常用于红外、紫外和真空紫外应用的专用光学器件。氟化锂有着低折射率、高紫外透射范围。氟化锂粉末用于热释光辐射剂量计(TLD):当样品暴露于辐射中时,它会产生晶体缺陷,而被加热时,晶体缺陷则通过释放蓝光来解决,蓝光的强度与吸收剂量成比例,从而允许对此进行量化。氟化锂有时也可用于望远镜的焦距透镜。
铌酸锂的高度非线性也使其在非线性光学应用中具有广泛的应用前景。它广泛用于移动电话和调制解调器等电信产品以及谐振晶体等部件。超过60%的手机内部都含有锂。
军事应用:
金属锂及其复合氢化物,如四氢化铝锂,可用作火箭推进剂的高能添加剂。四氢化铝锂本身也可以用作固体燃料。
含锂-6的氢化锂可在热核武器用作炸弹聚变阶段的燃料。
⑦核能应用:
锂-6是氚的生产原料和核聚变的中子吸收剂。但天然的锂中只含有约7.5%的锂-6。而锂-7则在核反应堆中用作冷却剂。锂也可以中和用于吸收多余的中子硼酸。
氘化锂是早期氢弹的核聚变燃料。当受到中子轰击时,锂-6和锂-7都能产生氚。尽管细节仍然保密,但锂-6氘化物仍在现代核武器中作为核聚变材料。
锂-7的氟化物可用于核反应堆的冷却剂。氟化锂的化学性质特别稳定,有着较低的熔点。此外,它的热中子俘获截面也足够低,不会影响核裂变反应堆内的裂变反应。
在假想的核聚变发电厂中,锂可用于生产氚。自然产生的氚是极其稀有的,因此必须通过用含锂的“毯子”包围反应等离子体来合成生产,其中等离子体中氘-氚反应产生的中子将裂变锂以产生更多的氚。
锂也被用作α粒子或氦核的来源。当锂-7被加速质子轰击时,形成铍-8,铍-8会裂变形成两个α粒子。
⑧医学应用
锂在治疗双相情感障碍方面很有用。锂盐也有助于精神分裂症和周期性抑郁症的相关诊断。但如果孕妇在怀孕前三个月以内服用含锂药物,可能会增加胎儿患三尖瓣下移畸形的风险。
除此之外,锂也被研究用于治疗丛集性头痛的潜在疗法。
4.生物学作用
锂的主要食物来源是谷物和蔬菜,在某些地区,饮用水中也含有一定量的锂。人类的摄取量因地点和饮食而有着不同差异。
锂在19世纪末首次在人体器官和胎儿组织中发现。人类并没有确定的锂缺乏症,但某些案件发生率与锂的摄入可能有着关系。锂的生化机制似乎是多因素的,并且与多种酶、激素和维生素以及生长和转化因子相关。现在证据似乎表明锂是必需的;建议70公斤的成年人锂的人体每日摄取推荐量为1000微克。
5. 预防措施
锂具有腐蚀性,需要进行特殊处理以避免与皮肤直接接触。锂尘埃或锂化合物会初刺激鼻子和喉咙,而更高剂量的暴露可导致肺内积液甚至肺水肿。锂单质应安全地储存在石蜡油等非反应性有机物中。
由于大多数类型的锂电池在短路时能够非常迅速地完全放电,进而导致过热并可能在热失控的过程中爆炸,所以如飞机等运输工具会禁止某些锂电池的运输。而大多数消费型锂电池具有内置的热过载保护,用于防止事故发生。

