唯一衣壳致癌的病毒——丙肝病毒(HCV)
今天介绍的是丙肝病毒(Hepatitis C Virus/Hepacivirus C/HCV),它是黄病毒家族(Flavivirus)的一员。
简介



丙肝病毒(HCV)是黄病毒科的小型(55-65nm)包膜正义RNA病毒。 丙肝病毒是丙型肝炎和人类某些癌症[例如肝癌(肝细胞癌,简称HCC)和淋巴瘤]的病因。
分类
丙肝病毒属于黄病毒家族的丙肝病毒属/海帕希病毒(Hepacivirus)。 在2011年之前,它被认为是该属的唯一成员。后来,犬丙肝病毒/犬海帕希病毒(Canine Hepacivirus)与马丙肝病毒/马海帕希病毒(Equine Hepacivirus)也被归为丙肝病毒家族。此外,在蝙蝠和啮齿动物中已经发现了丙肝病毒。
结构

丙肝病毒颗粒由直径为55至65 nm的脂质膜包膜组成。两个病毒包膜糖蛋白E1和E2嵌入脂质包膜中,它们形成三角系数T=3类似的结构,并参与病毒附着并进入细胞。外壳内是直径为33至40nm的二十面体核心,核心是病毒的正义RNA。
E1和E2糖蛋白



当E1和E2嵌入HCV的包膜时,它们是共价键合的,并通过二硫键稳定。 E2是球形的,根据电子显微镜图像,E2似乎从包膜伸出的长度大约为6nm。
这些糖蛋白在丙肝病毒与免疫系统的相互作用中起重要作用。在E2糖蛋白上可以找到一个高变区,即高变区1(HVR1)。HVR1非常灵活,周围的分子也很容易接近。HVR1帮助E2将病毒与免疫系统隔离。它可以防止CD81闩锁在病毒的相应受体上。此外,E2可以使E1免受免疫系统的侵害。尽管HVR1的氨基酸序列变化很大,但该区域在许多E2糖蛋白上具有相似的化学,物理和构象特征。
HCV E1/E2蛋白的跨膜区具有内质网滞留序列,因此,在制备丙肝病毒包装的病毒样颗粒时,必须注意这个问题。
通过生物技术,将HCV E1/E2的跨膜区替换成在细胞膜出芽的跨膜区,人们成功制备了丙肝病毒E1/E2包装的慢病毒载体,用于抗病毒药物的筛选及基因治疗。丙肝病毒是唯一一个慢病毒包装成功的黄病毒,其他的黄病毒虽说可以进行慢病毒包装,但是滴度不高。
基因组

丙肝病毒具有单链正义RNA基因组。基因组由一个9646个核苷酸(代表毒株HCV 1a H77)长的单一开放阅读框组成,该单一开放阅读框经过翻译后产生了一个蛋白质产物。这就是为什么在公开可用的数据库(例如NCBI)上,病毒蛋白质组包含2种蛋白质的原因。

RNA的5'和3'末端是未翻译区域(UTR),该区域未翻译成蛋白质,但对病毒RNA的翻译和复制很重要。5'UTR具有核糖体结合位点或内部核糖体进入位点(IRES),其起始包含约3000个氨基酸的非常长的蛋白质的翻译。 HCV IRES的核心结构域包含一个整合在预测假结中的四向螺旋Holliday Junction,此核心结构域的构象限制了开放阅读框在40S核糖体亚基上的定位。较大的前蛋白随后被细胞和病毒蛋白酶裂解为10种较小的蛋白,这些蛋白可以在宿主细胞内进行病毒复制或组装成成熟的病毒颗粒。丙肝病毒产生的结构蛋白包括核心蛋白、E1和E2 ,非结构蛋白包括NS2、NS3、NS4A、NS4B、NS5A和NS5B。
分子生物学
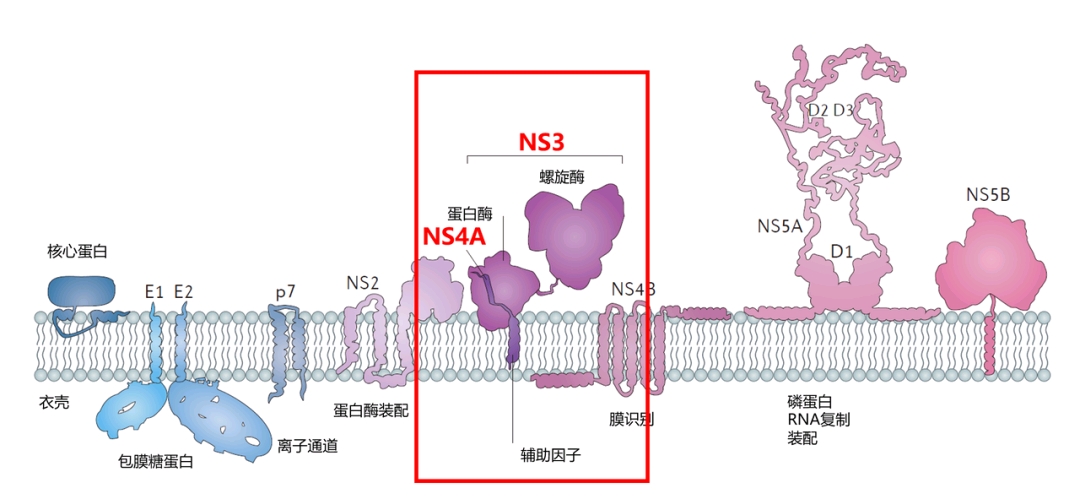
病毒的蛋白质按以下顺序排列在基因组中:N末端—核心(C)—E1—E2—p7—非结构蛋白2(NS2)—NS3—NS4A—NS4B—NS5A—NS5B—C末端。成熟的非结构蛋白(NS2至NS5B)的产生依赖于病毒蛋白酶的活性。NS2/NS3连接被编码在NS2和NS3 N端的金属依赖性自催化蛋白酶切割。该位点下游的其余裂解由同样包含在NS3 N端区域内的丝氨酸蛋白酶催化。

核心蛋白有191个氨基酸,根据疏水性可分为三个结构域:结构域1(残基1–117)主要包含带有两个短疏水区域的碱性残基;域2(残基118-174)的碱性较低,疏水性更大,其C末端位于p21末端;结构域3(残基175-191)高度疏水,可作为E1包膜蛋白的信号序列。
巧合的很,核心蛋白也是病毒引起细胞癌变的罪魁祸首,因此丙肝病毒是人类致癌病毒中,唯一一个衣壳蛋白致癌的病毒。其他的人类致癌病毒,要么是病毒自身携带的癌基因——乙肝病毒;要么是病毒的自身的基因组随机整合导致原癌基因被激活——HTLV;要么是病毒抑制免疫系统活性——HIV。
两种包膜蛋白(E1和E2)都高度糖基化,在细胞进入过程中很重要。 E1充当融合亚基,E2充当受体结合蛋白。 E1具有4–5个N-连接的聚糖,E2具有11个N-糖基化位点。
NS1(p7)蛋白可用于病毒基因组复制,但在病毒形态发生中起关键作用。该蛋白是一个63个氨基酸的跨膜蛋白,其自身位于内质网中。 p7的切割是由内质网的信号肽酶介导的。p7的两个跨膜结构域通过细胞质环连接,并朝向内质网腔。
NS2蛋白是一种具有蛋白酶活性的21-23千道尔顿(kDa)跨膜蛋白。
NS3是67kDa的蛋白质,其N端具有丝氨酸蛋白酶活性,而C端具有NTPase/解旋酶活性。它位于内质网内,与NS4A形成异二聚体复合物,后者是一种54个氨基酸的膜蛋白,可作为蛋白酶的辅助因子。
NS4A是一种54个氨基酸的膜蛋白,可作为蛋白酶的辅助因子。
NS4B是一种小的(27 kDa)疏水性完整膜蛋白,具有四个跨膜结构域。它位于内质网内,对募集其他病毒蛋白起重要作用。它诱导内质网的形态变化,形成称为膜状网的结构。
NS5A是一种亲水性磷蛋白,在病毒复制,细胞信号传导途径的调节和干扰素应答中起重要作用。已知与内质网锚定的人类VAP蛋白结合。
NS5B蛋白(65 kDa)是病毒RNA依赖性RNA聚合酶。 NS5B具有关键功能,它以病毒的正义RNA链为模板来复制HCV的病毒RNA,并在RNA复制过程中催化核糖核苷三磷酸(rNTP)的聚合。已基于相同的共有序列BK(HCV-BK,基因型1)确定了几种晶体形式的NS5B聚合酶的几种晶体结构。该结构可以用手指、手掌和拇指的右手形状表示。 NS5B特有的环绕的活性位点包含在蛋白质的棕榈结构中。对NS5B蛋白基因1b株J4的新研究(HC-J4)结构表明存在活性位点,在该位点可能发生核苷酸结合的控制,并且开始了新RNA合成。De-novo添加了必要的引物来启动RNA复制。当前的研究试图将结构结合到该活性位点以改变其功能,以防止进一步的病毒RNA复制。
科学家还发现了第11种蛋白质——F。该蛋白由衣壳基因中的+1移码编码。它似乎具有抗原性,但功能未知。
病毒的复制

丙肝病毒的复制包括几个步骤。病毒主要在肝脏的肝细胞中复制,据估计,每个受感染细胞每天产生大约50个病毒粒子(病毒颗粒),估计总共产生1兆个(1万亿=1兆)病毒粒子。该病毒也可能在外周血单个核细胞中复制,这可能是慢性感染丙型肝炎患者出现高水平免疫紊乱的原因。在肝脏中,丙肝病毒颗粒通过血液流动进入肝窦。这些肝窦与肝细胞相邻。丙型肝炎病毒能够通过肝窦的内皮细胞并到达肝细胞的基底外侧表面。
丙肝病毒有多种基因型,由于依赖RNA的RNA聚合酶出错率高,因此突变迅速。突变率产生如此多的病毒变种,它被认为是准种而不是传统的病毒种。病毒粒子通过复杂的相互作用进入宿主细胞,特别是通过它们的糖蛋白和细胞表面分子CD81、LDL受体、SR-BI、DC-SIGN、Claudin-1和Occludin。
HCV的包膜类似于极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)。由于这种相似性,人们认为这种病毒能够与载脂蛋白相结合。它可以被脂蛋白包围,部分覆盖E1和E2。最近的研究表明,这些载脂蛋白与清除受体B1(SR-B1)相互作用。SR-B1能够从病毒周围的脂蛋白中清除脂质,以便更好地与HVR1接触。Claudin 1是一种紧密连接蛋白,它和CD81结合形成一个复合体,为稍后的HCV感染过程启动。当免疫系统被触发时,巨噬细胞在被感染的肝细胞周围增加TNF-α的数量。这触发闭塞蛋白的迁移,闭塞蛋白是另一种紧密连接复合物,到基底外侧膜。丙肝病毒粒子已经准备好进入细胞。
这些相互作用导致病毒粒子的内吞作用。这一过程得到网格蛋白的帮助。一旦进入早期核内体,核内体和病毒包膜融合,RNA被允许进入细胞质。
随后,病毒接管部分细胞内机制进行复制。丙肝病毒的基因组被翻译成一个由大约3011个氨基酸组成的蛋白质。然后,该多聚蛋白被病毒和细胞蛋白酶水解,产生3个结构蛋白(病毒粒子相关)和7个非结构蛋白(NS)。另外,核心区域也可能发生帧移,以产生替代阅读框蛋白(ARFP)。HCV编码两种蛋白酶,NS2半胱氨酸自蛋白酶和NS3-4A丝氨酸蛋白酶。然后NS蛋白将病毒基因组招募到RNA复制复合体中,这与重新排列的细胞质膜有关。RNA复制通过依赖于病毒RNA的RNA聚合酶NS5B进行,它以正以RNA为模板,合成产生反义RNA,进而形成双链RNA中间体。然后反义RNA作为模板产生新的正义RNA。新生的正义RNA可以被翻译,进一步复制或包装在新的病毒颗粒中。
基因分型
根据HCV分离株之间的遗传差异,将丙肝病毒分为六种基因型(1-6),每种基因型内有几种亚型(以小写字母表示)。根据亚型的遗传多样性将其进一步细分为准种。基因型在整个基因组中的核苷酸位点相差30–35%。基因型亚型的基因组组成差异通常为20–25%。亚型1a和1b在世界范围内发现,占所有病例的60%。
临床重要性
基因型在确定对基于干扰素的疗法的潜在反应以及此类疗法所需的持续时间方面具有重要的临床意义。基因型1和4对其他干扰基因型(2、3、5和6)对基于干扰素的治疗的反应较小。基因型1和4的基于干扰素的标准治疗时间为48周,而基因型2和3的治疗则在24周内完成。持续的病毒学应答发生在基因型1的70%,基因型2和3的〜90%,基因型4的〜65%和基因型6的〜80%。此外,非洲裔感染基因型1或4的人对治疗的反应要少得多。据认为,对治疗缺乏反应的很大一部分是由人类基因组19号染色体上的单核苷酸多态性(SNP)引起的,该多态性可预测治疗成功。HCV基因型1和4已在西非和中部非洲的重叠地区流行分布,感染携带了上述遗传多态性的人类已有数百年的历史了。这促使科学家们提出,非洲裔人群中HCV基因型1和4的长期持续存在是HCV在多个世纪以来对这些人群的免疫遗传反应的进化适应。
感染一种基因型不会赋予针对其他基因型的免疫力,并且可能同时感染两种菌株。在大多数情况下,其中一株在短时间内胜过另一株。这一发现可能对治疗有用,可以用更易于治疗的其他药物替代对药物无反应的菌株。
重组
当两种病毒感染同一细胞时,可能发生基因重组。尽管不常见,但在不同基因型之间,相同基因型的亚型之间,甚至在相同亚型的菌株之间也观察到了HCV重组。
传染病学
丙肝病毒主要是血液传播的病毒,其性传播或垂直传播的风险非常低。由于这种传播方式,处于危险中的关键人群是静脉**者,血液制品的接受者,有时还有接受血液透析的患者。医源传播也是HCV传播的常见方式,如果临床中未正确遵循卫生和绝育的做法。已经提出了许多文化或礼节习俗作为HCV传播的潜在历史模式,包括*皮环*术,外*残割,礼节性划伤,传统*身和针灸。也有人认为,鉴于人类丙肝病毒的持续时间极长,即使通过叮咬昆虫传播的机械传播速率极低且无法检测到,也足以维持热带地区的地方性感染,那里人们会受到大量昆虫叮咬。
病毒进化
很难确定丙肝病毒的起源,但是基因型1和4似乎具有共同的起源。贝叶斯分析表明,大约300–400年前,主要基因型与普通祖先病毒存在差异。大约200年前,次要基因型与主要基因型有所不同。所有现存的基因型似乎都是从基因型1亚型1b进化而来的。
对基因型6菌株的研究表明,其进化的日期更早:大约在目前的1100至1350年之前。估计的突变率为1.8×10^-4。一项实验研究估计,每年每个位点的突变率为2.5~2.9×10^−3个碱基取代。该基因型可能是其他基因型的祖先。
对欧洲,美国和日本分离株的研究表明,基因型1b的起源日期大约是1925年。2a型和3a型的预计起源日期分别是1917年和1943年。 1a型和1b型的发散时间估计为200-300年。
基因型1a和1b的研究估计,类型1a的起源日期为1914–1930年,类型1b的起源日期为1911–1944。在1940年至1960年之间,1a和1b型都经历了有效人口规模的大规模扩张。HCV 1b亚型的扩张至少要先于1a亚型16年。两种类型似乎都已从发达国家传播到了发展中国家。
来自非洲的基因型2菌株可分为与其来源国相关的四个进化枝:1.喀麦隆和中非共和国2.贝宁,加纳和布基纳法索3.冈比亚,几内亚,几内亚比绍和塞内加尔4.马达加斯加。也有强有力的证据表明,跨大西洋的奴隶贸易将HCV基因型2从西非传播到加勒比地区。
基因型3被认为起源于东南亚。
来自这些不同国家的日期表明该病毒可能在东南亚发展,并由西欧商人传播到西非。后来,日本解除了对日本的自我隔离,将其引入日本。一经引入一个国家,其传播就受到许多当地因素的影响,包括输血,疫苗接种计划,静脉内**和治疗方案。鉴于1990年代开始对血液制品中的HCV进行筛查后,传播速度有所降低,因此以前的输血似乎是一种重要的传播方法。需要进行额外的工作来确定各种基因型的进化日期及其在全球传播的时间。
病毒研究
与甲肝和乙肝不同,目前没有预防丙肝病毒感染的疫苗。所以,如果你感染了丙肝病毒,你还是祷告吧……
HCV的宿主范围狭窄,阻碍了对HCV的研究。虽然复制子的使用已经成功,但是直到最近才成功制备它们。HCV与大多数RNA病毒一样,都是病毒准种,因此很难分离出单个菌株或受体类型进行研究。
当前的研究集中在病毒蛋白酶,RNA聚合酶和其他非结构基因的小分子抑制剂上。 NS3蛋白酶的两种抑制剂:默克公司的Boceprevir和Vertex Pharmaceuticals公司的Telaprevir均分别于2011年5月13日和2011年5月23日批准使用。
据报道,维生素D水平低与对治疗的不良反应之间可能存在关联。体外研究表明,维生素D可能能够减少病毒复制。尽管这项工作看起来很有希望,但临床试验的结果尚在等待中。有人提出,除了标准治疗外,补充维生素D也是重要的,以增强治疗反应。
柚皮素(Naringenin),一种在葡萄柚和其他水果和草药中发现的类黄酮,已被证明能阻止细胞内感染性病毒颗粒的组装,而不会影响细胞内病毒RNA或蛋白质的水平。
正在研究的其他药物包括RNA依赖性RNA聚合酶的核苷和核苷酸类似物抑制剂和非核苷抑制剂,NSP5A抑制剂以及靶向宿主的化合物,例如亲环蛋白抑制剂和水飞蓟宾。
FDA在2013年12月6日批准了用于治疗慢性丙肝的Sofosbuvir。据报道,Sofosbuvir是第一种在无需联合使用干扰素的情况下具有治疗某些类型HCV感染的安全性和有效性的药物。11月22日,FDA批准Simeprevir与聚乙二醇干扰素-α和利巴韦林联用。Simeprevir已在日本被批准用于治疗基因型1的慢性丙肝病毒感染。
目前也有非药物相关疗法的实验研究。例如,氧化苦参碱是一种在亚洲大陆发现的根提取物,据报道在细胞培养和动物研究中,氧化苦参碱具有抗HCV的抗病毒活性。小型且有希望的人体试验已显示出有益的结果,并且没有严重的副作用,但是它们太小,无法概括结论。
2020年10月5日,宣布因发现HCV而被Harvey J. Alter,Michael Houghton和Charles M. Rice获得2020年诺贝尔生理学或医学奖。
抗病毒治疗
随着分子病毒学和基因组学的进步,我们通过对HCV生活周期研究发现了几个关键的药物靶点。其中,非结构性蛋白3(NS3)和其辅助因子NS4A所组成的NS3/4A复合物就是靶点之一。
NS3/4A是HCV安插在宿主细胞内质网膜上的重要病毒蛋白酶,它的主要任务就是把HCV基因组翻译出来的多聚蛋白进行剪切,形成最终可用的病毒蛋白。举个例子来说,病毒多聚蛋白就像是大块的面料,而NS3/4A就是裁缝师傅的剪刀,对面料进行裁剪加工,以便最后缝制成衣(病毒颗粒的装配)。
如果有一种药物能够阻断NS3/4A的功能,那么HCV就无法产生病毒所需要的各种成熟病毒蛋白。HCV后续的病毒颗粒装配难以为继,它在体内扩增感染的恶性循环也就被打破了。这种就是蛋白酶抑制剂(PI)。
从结构上而言,PI都是经过结构性修饰的NS3/4A蛋白酶的底物,通过竞争结合位点来抑制蛋白酶活性的作用。这么说或许不易理解,不妨再举个例子。如果把NS3/4A蛋白酶比作墙上的电插座,那么PI就像是防触电塑料插头。当它插在插座上时,就会阻挡其他电器的插头接通电源,插座为电器供电的功能也就被阻断了。针对病毒关键蛋白酶进行抑制的思路是抗病毒药物研发最主要策略之一。

