高二化学 选择性必修一 高二化学选修二 选修2 2021新人教版 同步课程 高考

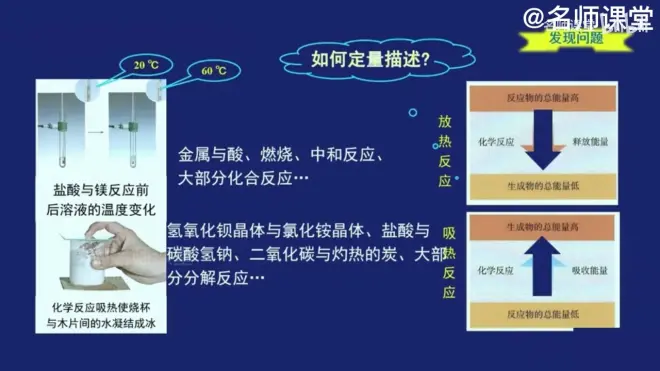
放热反应:
1.可燃物的燃烧(肯定是放热)
2.酸碱中和(肯定放热)
3.金属与酸反应
4.反应条件为"点燃"的,如铁在氯气中的燃烧
吸热反应:
1.反应条件为"加热"
2.反应条件为"高温"
3.一些特殊反应,如氯化铵固体与氢氧化钡晶体的混合研磨.
第1课时 反应热 热化学方程式 P1 - 03:30

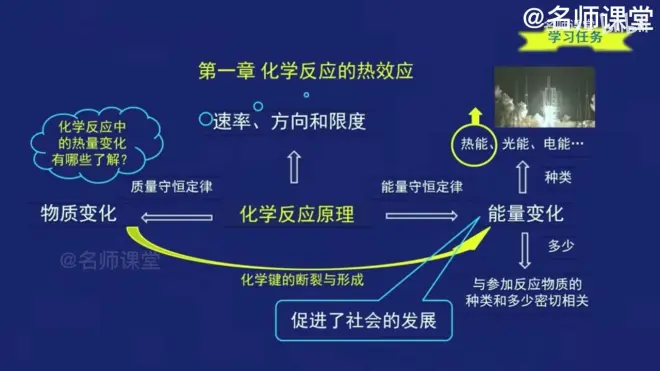
反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。

中和反应反应热的测定
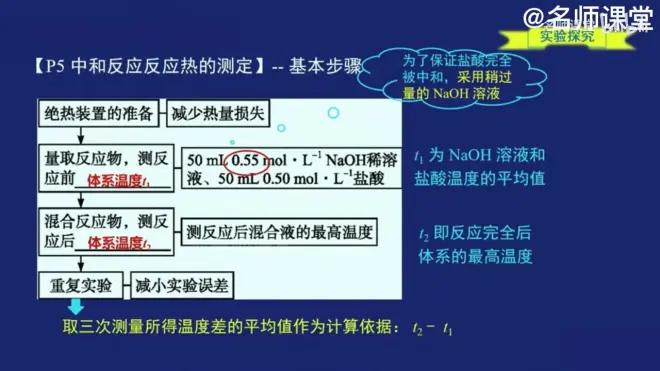
提高反应热准确度的措施

产生反应热的原因

判断化学反应的焓变

化学键的断裂和形成时的能量变化是化学反应中能量的主要原因
第1课时 反应热 热化学方程式 P1 - 17:04

注意:
1、需注明反应时的温度压强,温度压强不同,反应的△H不同。但中学所用△H的数据一般都是在25℃和101kPa下,因此可不注明。
2、需注明反应物和生成物的聚集状态(s、l、g、aq)。因为物质的聚集状态不同时,它们所具有的内能、焓也均不同。
3、热化学方程式中各物质前的化学计量可以是整数,也可以是分数。因此,书写热化学方程式是,△H必须与化学方程式一一对应。
第1课时 反应热 热化学方程式 P1 - 20:31


