最常见的沙粒病毒(嵌沙病毒)——淋巴细胞脉络丛脑膜炎病毒(LCMV)
今天介绍的是最常见的沙粒病毒(嵌沙病毒)——淋巴细胞脉络丛脑膜炎病毒(Lymphocytic choriomeningitis virus/Lymphocytic choriomeningitis mammarenavirus/LCMV)。
简介



淋巴细胞脉络丛脑膜炎病毒(Lymphocytic choriomeningitis virus,以下简称LCMV)是一种球形包膜病毒,直径在60~300nm之间。螺旋核衣壳包含一个由两个反义RNA片段组成的RNA基因组。反义RNA与正义mRNA链互补,表明它必须首先被转录成正义mRNA链,然后才能翻译成所需的蛋白质。

病毒有两个反义RNA链: L链和S链。L链是双义RNA,编码相反方向的多种蛋白质,被一个基因间区域隔开。它的大小约为7.2kb,编码一个RNA依赖的RNA聚合酶(L; 200kDa)和一个11kDa的基质蛋白Z,基质蛋白Z功能未知,并含有无名指基序。病毒RNA依赖的RNA聚合酶由L编码在所有依赖RNA的RNA聚合酶中均包含保守特征基序的蛋白质。 S链也是双义RNA,约3.4 kb,编码两种主要结构蛋白:核蛋白N(63 kDa)和糖蛋白GPC(75kDa),后者经过翻译后切割并合成两种成熟的病毒体糖蛋白, GP1(40至46 kDa)和GP1(35 kDa)。病毒粒子包膜上的棘突由GP1和GP2的四聚体形成决定。
病毒的核蛋白N与RNA聚合酶L结合之后,会形成3'-5'外切酶。在RNA的转录与复制中提供校正作用,以降低错配率。(冠状病毒的RNA聚合酶1ab也拥有3'-5'外切酶nsp14)

当LCMV攻击细胞时,复制过程开始于病毒通过其表面糖蛋白附着于宿主受体,然后被内吞到宿主细胞内的囊泡中,并形成病毒和囊膜的融合体。然后核糖衣壳在细胞质中释放。随病毒携带的RNA依赖性RNA聚合酶最初与L和S区段的启动子结合,并开始从负链转录成正链mRNA。在每个基因的末端形成强大的发夹序列会终止转录.mRNA链在细胞质中被RNA依赖性RNA聚合酶封盖,然后被翻译成LCMV组装所必需的四种蛋白质。核糖衣壳与Z基质蛋白相互作用并在细胞膜上发芽,从而使病毒体从被感染的细胞中释放出来
淋巴细胞脉络丛脑膜炎病毒是第一种沙粒病毒,全称淋巴细胞性脉络膜脑膜炎哺乳动物沙粒病毒(Lymphocytic choriomeningitis mammarenavirus,LCMV),于1933年由查尔斯·阿姆斯特朗(Charles Armstrong)在圣路易斯进行的一次流行病研究中分离出。尽管不是流行性脑膜炎的爆发原因,但已证明LCMV是非细菌性或无菌性脑膜炎的原因。
1996年,彼得·多尔蒂(Peter Doherty)和罗尔夫·辛克纳格尔(Rolf Zinkernagel)因合作研究LCMV,因而共同获得了诺贝尔医学和生理学奖,这使人们对适应性免疫应答MHC限制有了基本了解。在1970年代,关于MHC基因座重要性的研究仅在移植和肿瘤排斥中进行。考虑到这一点,Doherty和Zinkernagel正在研究小鼠对病毒感染的反应。他们观察到,T细胞受体必须识别外源抗原和MHC抗原的复合物才能破坏感染的细胞。他们的关键实验涉及从受感染的小鼠品系A中收获含有LCMV特异性细胞毒性T淋巴细胞(CTL)的脾细胞。然后将它们与来自病毒感染的成纤维细胞或来自两种不同小鼠品系A和B的巨噬细胞进行体外混合。 铬释放细胞毒性试验,从而用铬51(Cr-51,一种铬的放射性同位素)标记CTL,通过铬51的释放来量化感染细胞的CTL破坏。结果表明,CTL仅杀死了菌株A的感染细胞,而没有裂解未感染的细胞或菌株B的感染细胞。他们得出的结论是,这些病毒特异性CTL只能裂解携带相同主要组织相容性位点(MHC)分子的细胞。作为CTL本身。因此,病毒特异性CTL受MHC限制。这一发现使人们对免疫系统的重要方面有了更深入的了解。
分布
LCMV由普通家鼠小家鼠自然传播,一旦感染,这些小鼠可通过维持血液中的病毒或持续尿液中的病毒而被慢性感染。慢性感染的雌性小鼠通常将感染传播给其后代(垂直传播),后者继而成为慢性感染。老鼠到老鼠的其他传播方式包括鼻分泌物,受感染水坝的牛奶,鼠类咬伤以及老鼠社区内的社交期间。空气传播也会发生。 该病毒似乎对干燥具有相对的抵抗力,因此,通过吸入啮齿动物尿液,粪便或唾液的感染性雾化颗粒,摄入被病毒污染的食物,感染的体液污染粘膜或直接暴露,人可能被感染。伤口或其他开放性伤口以感染病毒的血液。仅有的从动物传播的案例是在人与小鼠或仓鼠之间发生的。 在北美洲和南美洲,欧洲,澳大利亚和日本,特别是在1900年代,都报告了淋巴细胞脉络膜脑膜炎的病例。但是,只要有被感染的啮齿动物宿主存在,就可能发生感染。 LCMV遍布全球,其自然宿主啮齿动物在南极洲以外的所有大洲都已建立。 LCMV血清阳性率约为美国人口的5%(0.7-4.7%)。它在社会经济地位较低的人群中更常见,可能反映了与小鼠的更频繁和直接的接触。但是,由于漏报,很难按地理区域获得准确的流行区域。
先天性感染
淋巴细胞性脉络膜脑膜炎是产科特别关注的问题,因为已知会发生垂直传播。对于具有免疫能力的母亲,没有明显的威胁,但是这种病毒对胎儿具有破坏性作用。如果在早孕期发生感染,LCMV会导致自然流产的风险增加;先天性感染可能导致畸形,例如颅内钙化,脑积水,小头畸形或大头畸形,智力障碍和癫痫发作;其他发现包括脉络膜视网膜疤痕和视神经萎缩。脉络膜视网膜炎继之以脉络膜视网膜瘢痕化是最常见的眼部病变,婴儿的死亡率约为30%。在幸存者中,三分之二具有持久的神经系统异常。
还可以看到其他眼缺陷,包括视神经萎缩,小眼症,玻璃体炎,白细胞减少和白内障。一个病例系列中的大多数婴儿体重正常,尽管30%体重不足。吸入性肺炎可能是致命的并发症。存活的婴儿可能患有严重的神经系统缺陷,包括癫痫病,协调能力受损,视力丧失或失明,痉挛性双瘫或四肢瘫痪/四肢瘫痪,发育迟缓和智力障碍。也有少数病例有脉络膜视网膜炎的证据,但没有神经系统症状。体征似乎很少见,但在少数情况下已有肝脾肿大,血小板减少和高胆红素血症的报道,并且在一名婴儿中出现了皮肤水泡。
如果妇女在怀孕期间接触过啮齿动物并且表现出淋巴细胞脉络丛脑膜炎(LCM)症状,则可以进行血液检查以确定以前或当前的感染。感染史不会对未来怀孕构成风险。
器官捐献
实体器官移植感染的患者在移植后数周内开始出现严重的致命疾病,在所有报告的病例中,最初的症状包括发烧,嗜睡,厌食和白细胞减少症,并迅速发展为多系统器官衰竭,肝功能不全或严重肝炎,移植器官功能障碍,凝血功能障碍,缺氧,多种菌血症和休克。某些患者还出现局部皮疹和腹泻。几乎所有病例都是致命的。 2005年5月,四名实体器官移植受者感染了一种疾病,后来被诊断为淋巴细胞性脉络膜脑膜炎。所有的器官都是从一个共同的捐献者那里获得的,并且在移植的一个月之内,四个接受者中的三个是由于病毒感染而死亡的。流行病学调查表明该器官的来源是最近从罗德岛购买的一只宠物仓鼠。2008年在马萨诸塞州和2013年在澳大利亚发生了类似病例。美国食品药品监督管理局没有批准LCMV感染测试用于器官供体筛查。 《发病率和死亡率周报》建议医疗保健提供者“考虑对无菌性脑膜炎和脑炎患者以及患有无法解释的发热,肝炎或多系统器官衰竭的器官移植患者进行LCMV感染。”
预防
LCMV易被大多数洗涤剂和消毒剂杀死,包括1%的次氯酸钠,70%的乙醇,2%的戊二醛和甲醛。在pH=5.5以下和pH=8.5以上,感染的有效性迅速下降。此外,LCMV还可以通过加热,紫外线或伽马射线辐照灭活。 研究表明,人类对该病毒的感染主要发生在秋季和冬季,可能是由于小鼠在室内移动所致。可以采取几种措施来防止家中的野鼠传播LCMV。疾病控制与预防中心提供了一份预防措施清单,其中提供了一些技巧,以密封房屋以防止啮齿动物进入,使用陷阱消除现有的啮齿动物,并保持整洁,健康的房屋。新技术反映出一种越来越人性化的消除啮齿动物的趋势。产品包括发出超声波的设备,据称会刺激小鼠并将其赶走。但是,传统的捕捉器仍然是一种经济且受欢迎的选择。
治疗
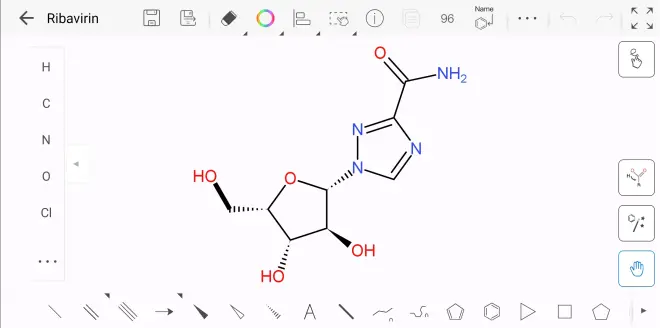
LCMV无特效药,主要治疗方式是对症治疗和支持性治疗。脑积水患儿经常需要进行脑室-腹膜分流。在某些情况下使用核苷类似物利巴韦林,因为该药物在体外对沙粒病毒具有抑制作用。但是,没有足够的证据证明对人类的功效可支持常规使用。移植相关LCMV感染的唯一幸存者接受了利巴韦林治疗,同时逐渐减少了免疫抑制药物。为了使疗效最大化,需要早期和静脉注射利巴韦林治疗,并且会产生相当大的副作用。利巴韦林尚未在对照临床试验中进行评估。 通常不建议在怀孕期间使用病毒唑(利巴韦林,Ribavirin),因为一些研究表明病毒唑有致畸作用的可能性。如果LCMV导致无菌性脑膜炎,脑炎或脑膜脑炎发展,则可能需要住院和支持治疗。在某些情况下,也可以考虑使用抗炎药。通常,死亡率不到百分之一。
罕见的RNA病毒整合
最近一项研究的作者发现,淋巴细胞脉络膜脑膜炎病毒(LCMV,一种经常研究的沙粒病毒)RNA基因组的DNA副本已整合到宿主细胞DNA中。 这个不寻常的故事始于1979年,据报道,在10^3至10^4个感染细胞中,大约有1个可以检测到与LCMV RNA基因组互补的DNA。 作者推测逆转录酶参与其中,但没有提供机理证据。 18年后,作者将这些细胞亚克隆以产生含有LCMV DNA的细胞系。 然后,他们使用聚合酶链反应从克隆的细胞中分离出LCMV DNA,包括病毒基因组两侧的细胞序列。 核苷酸序列分析表明,两种细胞系均含有病毒棘突蛋白(GPC)基因的一个副本,该基因与编码IAP(脑池内A型)反转录转座子的细胞序列相连。 作者确定了LCMV在培养细胞和感染小鼠中的整合。 根据他们的实验结果,作者提出在感染了LCMV的细胞中发生以下事件:在通过逆转录酶将逆转录转座子RNA复制为cDNA副本的过程中,该酶转换了模板并开始复制LCMV的GPC RNA。 这种杂合的DNA与LCMV序列连接的反转录转座子结合,然后整合到宿主基因组中。 本文报道的结果对进化和人类基因治疗具有重大意义。


由于逆转录转座子在胸腺和高玩中转座效率最高,因此所述重组事件可能导致RNA病毒基因在种系中传播。 因此,非逆转录RNA病毒对哺乳动物基因组进化的贡献可能比以前认为的要大。 此外,用于基因治疗的非逆转录RNA病毒载体有可能通过本研究中描述的机制整合到人类基因组中。 这种整合可能导致不希望的突变,例如原癌基因的激活。 因此,在批准将载体用于人类之前,应仔细测试RNA病毒载体整合到人类基因组中的能力。
附带一提
LCMV与拉沙病毒(LASV)均为沙粒病毒,但是LCMV分布比拉沙病毒广[LCMV全球分布,拉沙病毒(LASV)分布于非洲],而LCMV危险性比拉沙病毒弱得多[拉沙病毒(LASV)为生物安全等级4(BSL-4),LCMV-普通型为生物安全等级2(BSL-2),LCMV-神经亲和型为生物安全等级3(BSL-3),但是神经亲和型很少见。生物安全等级越高越危险,常见的非致死性病原体生物安全等级为1(BSL-1),常见的低中致死性病原体生物安全等级为2(BSL-2)(冠状病毒四大天王——229E、OC43、NL63、HKU1),常见的中高致死性病原体生物安全等级为3(BSL-3)(狂犬病毒),常见的高致死性病原体生物安全等级为4(BSL-4)(埃博拉病毒、马尔堡病毒、拉沙病毒、天花病毒与疱疹B病毒)]


