【PDB-101】2014年4月 结构生物学亮点:胰高血糖素受体【搬运·翻译】

GPCR(G蛋白偶联受体)们的外貌五花八门,每个都得准确地识别属于自己的信号分子。近来,参与GPCR Network的PSI研究人员解明了胰高血糖素受体的结构。他们看到的不仅是它那标志性的七次跨膜螺旋结构,更是一大类识别短肽信号分子的GPCR共有的原子级结构细节。这个结构以及与它相似的促肾上腺皮质激素释放激素受体-1(ATP吐槽:这名字真长)的结构向我们展示了所谓“B类GPCR”与其他GPCR们的异同之处。
蛋白三明治
B类GPCR的结构特征就是具有两个结构域。其中一个结构域就是个平平无奇的跨膜结构域(上图中绿松石色的部分),形成的一圈α螺旋看起来跟其他GPCR没什么两样,负责把激素(粉色)的结合和胞内G蛋白的激活偶联在一起;另一个结构域(深蓝色)位于受体的胞外部分,学界认为激素要先被它捕获,然后才转交给跨膜结构域结合。
一部分一部分来
这些GPCR生得柔韧灵活,为结构研究带来了不小的挑战。为了研究它们,人们不得不动用“分而治之”的方法:把它们打碎成方便处理的小块,再对这些小块分别进行研究。研究者们已经得到了不少这类受体胞外结构域的结构,这些结构里有的只有胞外结构域自己,有的是它跟与它结合着的激素的合影。相比之下,跨膜结构域的结构要难搞得多,直到最近才有两个受体跨膜结构域的结构被解析清楚,这才使我们得以见到B类GPCR的全貌。这两个受体就是胰高血糖素受体(PDB条目4l6r)与促肾上腺皮质激素释放激素受体-1(PDB条目4k5y)。上图展示的是结合有胰高血糖素的完整胰高血糖素受体的模型,它的结构是PSI研究人员基于构象模拟、交联和突变研究得来的数据构建出来的。
激素类似物
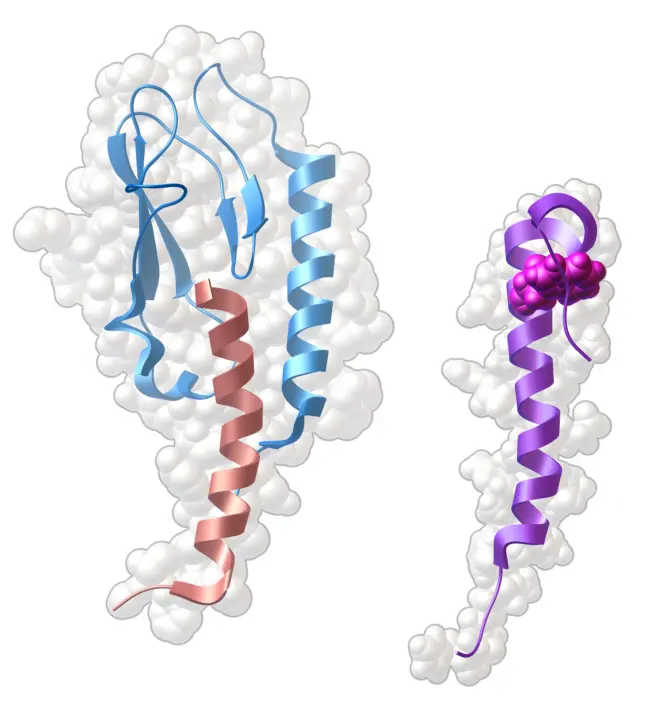
人们正在尝试用肽类激素的类似物调节它们的受体,为的是治疗像糖尿病这样的疾病。上图左侧展示了胰高血糖素样肽-1(粉色)与它受体的胞外结构域(蓝色)结合时的结构(PDB条目3iol)。就像胰高血糖素和它的受体一样,胰高血糖素样肽-1形成的α螺旋结构可能与受体的两个结构域都有相互作用。有一种从希拉毒蜥(Gila monster)的唾液中发现的短肽叫做exendin-4,它也与胰高血糖素样肽-1的受体结合,就像胰高血糖素样肽-1一样对胰岛素的释放起调控作用。不过,它的结构有一些特别的地方,比如一个特殊的色氨酸,它参与构成一个笼状结构(上图右,靠近最上方处)。这些结构特点有助于稳定它有活性的α螺旋构象。(ATP注:这个exendin-4的人工合成品已经是治糖尿病的药物了,药名叫艾塞那肽。)
一样,但不完全一样
为了破解这些受体结构的难解之谜,研究者们不得不像对付其他GPCR一样祭出蛋白质工程的技术:首先切掉受体的胞外结构域,然后在肽链中间插入一个稳定的小蛋白,让它成为结晶的“借力点”。下图中两个B类GPCR(PDB条目4l6r和4k5y,下图左与中)都拥有熟悉的一束跨膜α螺旋结构,不过它们这圈α螺旋在顶上张得更开,形成更大的结合位点,这样才能容得下大个头的肽类激素。如果你想看一看这两个新结构和A类GPCR的结构有什么区别,请前往原网页查看可互动的JSmol文件。
GPCR结构(PDB条目4k5y、4l6r和2rh1)

原网页的JSmol展示了2个B类GPCR和1个A类GPCR跨膜结构域的结构。注意B类GPCR的α螺旋在一侧张得更开,为的是形成用以容纳肽类激素的结合位点。(ATP注:其实上面这张图看得还挺清楚的,不过如果你想要360°无死角地欣赏这些小蛋白的话,可一定要去原网页玩一玩哦。)

之前预告过的胰高血糖素受体来喽=w=下一期应该会是腺苷受体吧!我本来想除夕或大年初一翻译点东西助助兴的,没想到写有关RyR2的东西耽误了太多时间……不得不说想把RyR2的事用不像写综述的方法说清楚真的很让人头疼,尤其是这玩意儿的事本就不怎么清楚……
好了,不说了,是时候扯些跟本篇主人公有关的事了!由于兴趣方向的问题,我对胰高血糖素受体的关注很少,之所以是很少而不是没有主要是因为它在心肌上也存在,可以通过激活cAMP-PKA通路增强心肌收缩力(话说刚好我正在写的有关于RyR2的东西就要讲到PKA)。这条信号通路的激活相对独立于β肾上腺素受体通路,所以当β受体阻断剂中毒引发心脏收缩功能障碍时,抢救措施之一就是注射胰高血糖素。不过呢,这点小小的缘分并不是我如此早地翻译这篇结构生物学亮点的理由,真正让我在翻完上篇后一眼相中了胰高血糖素受体的是它那独属于B类GPCR的鹤立鸡群的神奇长相。B类GPCR在结构上有两大特点,第一点是小巧可爱的胞外结构域,第二点则是宽广深长的配体结合位点。正文最后那张图特别能说明第二点,毕竟你不用特别认真地看就能发现,跟A类GPCR比起来,B类GPCR的上部就跟裂开了似的。事实上,B类GPCR的配体结合位点是已知所有GPCR中最宽、最深的,刚好适合容纳处于α螺旋构象中的短肽配体。

当然了,只有配体结合位点还不够,毕竟那么长一条短肽可不会自己乖乖地掉进这个“坑”里,得有个家伙拉它一把才行。看完正文的你肯定知道,这个家伙就是B类GPCR的胞外结构域,一个辅助结合配体的额外抓手。细致的结构研究发现,当周围不存在配体时,B类GPCR的胞外结构域会扣在跨膜结构域头顶上,覆盖住跨膜结构域的配体结合位点,形成所谓的自闭“关闭”构象。当受体与配体结合并激活时,它的胞外结构域就向上、向外移动,自身与配体结合的同时暴露出跨膜结构域上的配体结合位点,形成“开放”构象。这一观察结果多少印证了正文中提到的假说:配体先被胞外结构域捕获,然后转交给跨膜结构域。
因技术与能力限制,请前往原网页以查看原文中所有超链接以及可互动的JSmol文件。
强烈推荐去PDB-101官网查看原文,顺便探索一下这个干货满满的科普平台。
作者:David S. Goodsell
原文网址:https://pdb101.rcsb.org/learn/structural-biology-highlights/glucagon-receptor
结构生物学亮点文章目录:https://pdb101.rcsb.org/learn/structural-biology-highlights/index
PDB-101首页:https://pdb101.rcsb.org
RCSB PDB首页:https://www.rcsb.org
封面图出处:Mattedi, G., Acosta-Gutiérrez, S., Clark, T., and Gervasio, FL. A combined activation mechanism for the glucagon receptor. Proc Natl Acad Sci USA 117, 15414-15422 (2020). DOI: 10.1073/pnas.1921851117

