抑制USP2可消除癌症干细胞并增强TNBC对化疗的反应
写在前面
今天推荐的是由美国纽约州石溪大学药理学系在2019年3月28日发表于Cell Death & Disease(IF:5.967,JCR 2区)的一篇文章,通讯作者是Chia-Hsin Chan教授,研究表明抑制USP2可消除癌症干细胞并增强TNBC对化疗的反应性。
研究背景
三阴性乳腺癌(TNBC)是最具侵略性的乳腺癌亚型,在肿瘤中蕴藏着丰富的癌症干细胞(CSC)种群。传统的化疗是TNBC的标准治疗方法,但它对导致肿瘤复发和进展的CSC群体治疗效果较差。因此,确定控制CSC活性和扩展的核心分子途径对于开发有效的TNBC治疗方法至关重要。
摘要部分
作者表明,USP2通过激活自我更新因子Bmi1和通过Twist上调实现上皮-间质转化来维持CSC群体。从机制上讲,USP2通过消除β-TrCP介导的Twist泛素化促进Twist的稳定。动物研究表明,药物抑制USP2可以抑制肿瘤的发展,并使肿瘤对TNBC的化疗反应敏感。这表明针对USP2是解决TNBC的一种新的治疗策略。
研究内容
1.USP2基因在TNBC中上调,对TNBC中CSCs的扩增至关重要
作者通过cBioPortal对癌症基因组图谱(TCGA)数据集的生物信息学分析发现,USP2基因在大约20%的基底样乳腺肿瘤中是上调的。由于大多数(>85%)TNBC样本被归入基底样亚型,这一观察结果促使作者探究USP2在基底样TNBC中的潜在病理学作用。TNBC是乳腺癌中最具侵略性的亚型,具有CSC富集的特点。作者根据从BT549中分离出CSC群体,发现TNBC的CSC群体中USP2的表达明显高于非CSCs。
作者随后调查了USP2对CSC活性的影响。肿瘤球的形成实验表明,USP2的过表达增加了三种基底类TNBC细胞模型--BT549、MDA-MB-231和MDA-MB-157中肿瘤球的形成和数量。相反,敲除USP2的表达可以减少各种TNBC细胞系中肿瘤球的大小和数量。与这些观察一致,ALDEFLUO试验表明,USP2的敲低明显减少了CSC群体。这些结果表明,USP2在CSCs的自我更新和扩展中起着重要作用。ML364直接与USP2结合并选择性地抑制其酶活性,作者证明,ML364对USP2的药理抑制以剂量依赖的方式明显减少了TNBC肿瘤球的形成。

研究结论:SP2在CSCs的自我更新和扩展中起着重要作用,抑制USP2是针对CSCs的一种有前途的治疗方法。
2.USP2的缺失增强了TNBC细胞和CSCs对化疗的敏感性
作者发现,单独敲除或抑制USP2会降低TNBC细胞的活力。ML364对USP2的抑制大大增强了多柔比星或紫杉醇在多种TNBC细胞模型中的细胞毒性。为了阐明ML364与多柔比星的组合效应是否归因于USP2,作者用ML364处理Luciferas-和USP2-nockdown BT549细胞,发现ML364处理增强了多柔比星对Lucifase-nockdown BT549细胞的疗效,但同样的处理并没有进一步抑制USP2-nockdown细胞的生长,说明ML364通过抑制USP2增强了多柔比星的疗效。
作者实验发现,ML364与多柔比星联合使用可协同消除今天推荐的是由美国纽约州石溪大学药理学系在2019年3月28日发表于Cell Death & Disease(IF:5.967,JCR 2区)的一篇文章,通讯作者是Chia-Hsin Chan教授,研究表明抑制USP2可消除癌症干细胞并增强TNBC对化疗的反应性。
在这项研究中,作者发现USP2去泛素化酶在CSCs中上调,是CSCs的一个新的调节器。对USP2进行遗传和药物靶向治疗,可大幅抑制CSCs的自我更新、扩展和化疗抗性。作者表明,USP2通过激活自我更新因子Bmi1和通过Twist上调实现上皮-间质转化来维持CSC群体。从机制上讲,USP2通过消除β-TrCP介导的Twist泛素化促进Twist的稳定。动物研究表明,药物抑制USP2可以抑制肿瘤的发展,并使肿瘤对TNBC的化疗反应敏感。此外,组织学分析显示,USP2上调与淋巴结转移之间存在正相关。作者的研究结果共同证明了USP2在介导Twist激活和CSC富集方面的具有重要作用,这表明针对USP2是解决TNBC的一种新的治疗策略。
通过cBioPortal对癌症基因组图谱(TCGA)数据集的生物信息学分析发现,USP2基因在大约20%的基底样乳腺肿瘤中是上调的。由于大多数(>85%)TNBC样本被归入基底样亚型,这一观察结果促使作者探究USP2在基底样TNBC中的潜在病理学作用。TNBC是乳腺癌中最具侵略性的亚型,具有CSC富集的特点。作者根据从BT549中分离出CSC群体,发现TNBC的CSC群体中USP2的表达明显高于非CSCs。
作者随后调查了USP2对CSC活性的影响。肿瘤球的形成实验表明,USP2的过表达增加了三种基底类TNBC细胞模型--BT549、MDA-MB-231和MDA-MB-157中肿瘤球的形成和数量。相反,敲除USP2的表达可以减少各种TNBC细胞系中肿瘤球的大小和数量。与这些观察一致,ALDEFLUO试验表明,USP2的敲低明显减少了CSC群体。这些结果表明,USP2在CSCs的自我更新和扩展中起着重要作用。ML364直接与USP2结合并选择性地抑制其酶活性,作者证明,ML364对USP2的药理抑制以剂量依赖的方式明显减少了TNBC肿瘤球的形成。
鉴于USP2在CSC调节中的重要作用,作者试图确定USP2的抑制是否会增加TNBC对多柔比星和紫杉醇的敏感性。作者发现,单独敲除或抑制USP2会降低TNBC细胞的活力。此外,ML364对USP2的抑制大大增强了多柔比星或紫杉醇在多种TNBC细胞模型中的细胞毒性。为了阐明ML364与多柔比星的组合效应是否归因于USP2,作者用ML364处理Luciferas-和USP2-nockdown BT549细胞。作者发现,ML364处理增强了多柔比星对Lucifase-nockdown BT549细胞的疗效,但同样的处理并没有进一步抑制USP2-nockdown细胞的生长,说明ML364通过抑制USP2增强了多柔比星的疗效。
另一方面,作者实验发现,ML364与多柔比星联合使用可协同消除BT549和MDA-MB-157细胞中的CSC群体。此外,ALDEFLUO检测也有同样的联合治疗效果。

研究结论:对USP2的药理抑制有可能被用来提高TNBC的化疗效果。
3.USP2通过稳定Twist蛋白的表达调控Bmi1
最近的研究表明, Bmi1在维持CSC更新和CSC介导的肿瘤发生方面起着不可缺少的作用。作者随后探究USP2过度表达Bmi1的分子机制。先前报道指出Twist是Bmi1的转录因子,Twist过表达会增加Bmi1在各种癌细胞中的mRNA和蛋白表达。与这些观察一致,BT549细胞中Twist的敲除减少了Bmi1的蛋白表达,表明USP2通过Twist对Bmi1的诱导发挥作用。BT549和MDA-MB-157 TNBC细胞表现出高水平的Twist。
Western blot检测表明,在BT549和MDA-MB-157细胞中消减USP2的表达,大大降低了Twist的蛋白表达。此外,在USP2基因沉默后,Bmi1蛋白水平被发现下调。作者的Western blot和实时PCR检测表明,USP2的缺乏抑制了TNBC细胞中包括Ncadherin和Fibronectin在内的间质标志物的表达。这些结果突出表明,USP2是Twist的一个真正的上游调节器,并且是诱导Bmi1和EMT的原因。
为了进一步确定USP2在CSC群体中Twist蛋白表达中的作用,作者分析了从Lucifere-和USP2-knockodwn BT549和MDA-MB-157细胞中分离出的Twist蛋白表达。发现USP2的耗竭大大降低了肿瘤球体中的Twist蛋白水平。

研究结论:USP2是Twist的一个真正的上游调节器,并且是诱导Bmi1和EMT的原因,USP2在TNBC细胞和CSC群体中都能调节Twist蛋白的表达。
4.USP2通过裂解β-TrCP对Twists的蛋白去泛素化来稳定Twist
作者进行了IP实验,发现在BT549细胞中,内源性USP2和Twist之间有强烈的相互作用。MG132处理逆转了由USP2敲低介导的Twist下调。同样,在BT549和MDA-MB-157细胞中,由USP2抑制剂引起的Twist蛋白表达减少在MG132处理后得到了回补。这些结果表明,USP2通过防止蛋白酶体介导的蛋白分解来稳定Twist蛋白的表达。
泛素化试验显示,在MG132的存在下,过量表达野生型(WT)USP2能有效地去除Twist的泛素化,而USP2的酶活性C276A突变体则不能触发Twist的这种去泛素化事件。β-TrCP是一个主要的E3连接酶,能促进Twist泛素化,导致Twist的蛋白体降解。作者的数据显示,β-TrCP驱动的Twist泛素化被过量表达的USP2所抑制。K63连接的泛素化引导Twist定位到细胞核,以激活Twist在EMT和CSCs的功能。因此,作者研究了USP2是否能潜在地改变Twist的亚细胞定位。生化分馏试验和免疫荧光染色表明,ML364抑制USP2后,Twist在细胞膜和细胞核中的表达都被下调。
作者接下来描述了被USP2去除的Twist的泛素连接,发现USP2主要去除Twist的K48连接的多泛素化。这些结果表明,USP2通过拮抗Twist的K48连接的泛素化来稳定Twist。为了阐明USP2调节的Twist蛋白表达和肿瘤球的形成是否取决于其去泛素酶的活性,作者敲除USP2的细胞中重新表达了WT和催化不活跃的C276A突变体,shUSP2 #1。Western blot和肿瘤球形成试验表明,由USP2敲除介导的Twist蛋白水平下降和肿瘤球被WT而不是USP2的C276A突变体所回补。

研究结论:USP2是Twist和CSCs的真正调控者,而且这些USP2的功能取决于USP2的去泛素酶活性。
5.USP2通过Twist/Bmi1途径调控癌细胞迁移和CSC更新
作者接下来研究了USP2是否协调了基底类TNBC细胞的迁移。迁移试验显示,敲除USP2的表达会抑制癌细胞的迁移,反之,USP2的过表达会促进这种效果。此外,Twist促进的细胞迁移和CSC更新在ML364处理中被下调,说明了USP2和Twist之间的功能联系。作者接下来测试了抑制Bmi1对Twist诱导的肿瘤球的形成的影响,作者发现,PTC-209(Bmi1特异性小分子抑制剂)处理有效地减少了Twist诱导的肿瘤球的形成,再现了USP2对CSC自我更新的影响。

研究结论:USP2在CSC激活中功能的一个关键机制是wist/Bmi1途径。
6.药理抑制USP2可抑制肿瘤生长并增强肿瘤对多柔比星的敏感性
抑制Bmi1已被证明可以提高乳腺癌细胞对5-FU和辐射的敏感性。作者随后确定USP2的抑制是否会影响预先存在的TNBC的生长和化学敏感性。作者首先在免疫缺陷的小鼠中建立了BT549衍生的异种移植。肿瘤发生试验表明,ML364对BT549-衍生的肿瘤的重量和体积都表现出剂量依赖性的抑制。
免疫组化染色结果表明,ML364处理异种移植小鼠明显减少了肿瘤中Twist和Bmi1蛋白的表达,支持USP2通过Twist/Bmi1轴调节TNBC发展的结论。
鉴于USP2在消除CSC方面的深刻作用和与多柔比星的协同作用,作者测试多柔比星和ML364对TNBC肿瘤的联合治疗。作者的异种移植研究表明,低剂量的多柔比星仅能小幅抑制BT549衍生肿瘤的发展,但与ML364的联合治疗能使肿瘤对多柔比星的疗效更强。

研究结论:USP2抑制肿瘤生长并使肿瘤对预先存在的TNBC异种移植物的化疗反应更敏感。
7.USP2在高级别肿瘤中上调,USP2的表达与乳腺癌的淋巴结转移相关联
对TNBC患者衍生的异种移植的高级单细胞测序分析显示,CSCs是TNBC3中转移的起始因素。此外,作者的数据表明,USP2调节了TNBC细胞的迁移能力。为了探究USP2在癌症进展中的潜在临床意义,作者对223例乳腺肿瘤组织的USP2表达进行了免疫组化染色。组织学分析发现,在有淋巴结转移的患者切除的乳腺肿瘤中,USP2的表达是上调的。此外,乳腺肿瘤中的USP2表达与淋巴结转移的阶段(pN阶段)呈正相关。这些结果表明,USP2与乳腺癌的进展相关。此外,作者表明,USP2的表达与乳腺肿瘤标本中Twist和Bmi1的表达呈正相关。新数据支持USP2和Twist/Bmi1途径之间的功能联系。
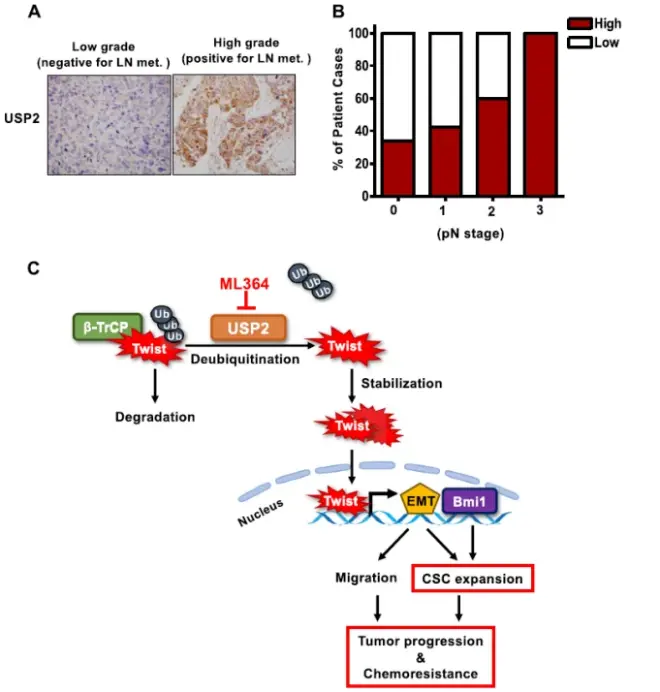
研究结论:USP2在TNBC中过量表达会促进Twist/Bmi1的表达、CSC扩展、癌细胞迁移和肿瘤发展。抑制USP2是消除CSCs和规避TNBC化疗阻力的可行策略。
结论与讨论
在这项研究中,作者发现去泛素化酶USP2是Twist和CSCs的一个新型激活剂,它可以通过减少Twist泛素化介导的蛋白酶体降解来稳定Twist表达。此外,研究表明,USP2是激活Twist/Bmi1途径和Twist介导的CSC特性所必需的。对USP2的遗传和药理抑制与化疗药物对CSC的消除显示出深刻的协同作用动物研究表明,USP2抑制剂能明显抑制肿瘤生长,提高TNBC的化疗疗效。此外,组织学分析发现, USP2蛋白的上调与乳腺肿瘤的淋巴结转移有关。USP2介导的Twist/Bmi1通路代表了除EMT外对CSC调节至关重要的细胞内在机制,并提供了临床前证据,表明靶向USP2确实是一种有潜力的抗CSC疗法。
Thank you!
原文链接:https://www.nature.com/articles/s41419-019-1512-6

