狼与家犬毛色遗传学杂谈:黑狼与白狼的诞生与生存及演化史

狼与家犬的基础毛色着色机理
色素沉淀是自然界中最明显的多态性状之一,表现于毛发、羽毛、鳞片等颜色的空间分布与色素类型。在所有的哺乳类与鸟类中,一组被称为黑素细胞(melanocytes)的特殊细胞负责生产黑色素(melanin),这些黑素细胞位于皮肤、毛发、眼睛、内耳、中枢神经系统和心脏,成熟的黑色素细胞通过一个被称为黑色素生成(melanogenesis)的过程产生黑色素,这些黑色素决定动物皮肤、毛发、眼睛、一些内膜以及鳞片和羽毛等身体覆盖物的颜色。
在脊椎动物胚胎发育过程中,被称为黑素母细胞(melanocytes)的黑素细胞前体形成于被称为神经嵴的外胚层区域,这些黑素母细胞会迁移到整个身体并增殖分化为成熟黑素细胞,能够产生黑色素。在这些成熟黑素细胞中有一种被称为黑素体的细胞器,可执行黑色素生成功能。皮肤中的黑素细胞的树突结构使周围的角质细胞渗透至整个表皮的基底层与毛囊中,黑素体通过这些树突转移至邻近的角质细胞中,用于产生色素。

在角质细胞中,黑素体产生两种类型的色素,分别为黑色或棕色的真黑素(eumelanin)与红色或黄色的类黑素(pheomelanin),这两种色素的类型与分布决定了动物毛发、眼睛、皮肤的颜色以及花纹与毛色的分布。
影响黑素细胞的变体通常也会影响其他由神经嵴衍生的细胞系(内分泌、神经、骨骼等)。黑素细胞也位于眼睛与内耳,因此一些色素表型经常与眼睛、听觉和神经功能受损的情况共同遗传。
在1957年,遗传学家利特尔(Clarence Little)在《狗的毛色遗传》(The Inheritance of Coat Colour in Dogs)中首次定义的犬类毛色表型,并且认为毛色表型是由一些基因的互作形成的。利特尔用按照字母的顺序排列的命名系统来确定这些基因的位置,分别为A(Agouti)、B(Black)、C(Chinchilla)、D(Dilute)、E(Extension)、G(Grey)、M(Merle)、P(Pink-eyed dilution)、S(Spotting)和T(Ticking)基因座。另外一个R基因座,代表Roan(毛色斑驳),也被假定,如今已被认为与T基因座相同。如今除了C基因座和P基因座已不再被认可外,上述定义仍然是用于描述控制家犬毛色表型基因的常用术语。B基因座最初被认为产生黑色毛发,如今已被修订成代表棕色毛发的B。另外两个基因座,K(Black)和I(Intensity)基因座被用来描述毛色的进一步变化。到2021年,已知共有15个基因狼与家犬的毛色表型上起作用。许多毛色表型是由基因座内和基因座之间的复杂的相互作用(如上位遗传 epistatic genetic)造成的,其中一些仍未被确认。
在家犬和狼的毛发中,毛囊内的胞内信号通路调节色素的合成。黑皮素1受体(MC1R)基因、Agouti信号蛋白(ASIP)基因和犬β防御素103(CBD103)基因在这一途径中调节真黑素与类黑素的相对合成量。这三个基因的相互作用通过一个叫做色素类型转换(pigment-type switching)的过程决定家犬与狼的基础毛色。

E基因座
E基因座上的MC1R基因位于狼和家犬的5号染色体上,编码一个黑素细胞跨膜域受体,是一种G蛋白偶联受体,通过cAMP信号通路激活真黑素合成,随后上调酪氨酸酶(TYR)、酪氨酸酶相关蛋白1(TYRP1. I)、OCA2黑素体跨膜蛋白(OCA2)和黑素体前体蛋白(PMEL)基因。位于24号染色体A基因座的ASIP基因编码的细胞外配体与MC1R结合来拮抗cAMP信号通路,阻止a-黑素细胞刺激素(a-Melanocyte Stimulating Hormone)与MC1R结合来抑制真黑素合成,同时编码一种旁分泌信号分子来促进类黑素合成。所以那些MC1R功能增强的变体或ASIP功能丧失的变体有利于真黑素而非类黑素的产生,反之亦然。位于16号染色体K基因座的CBD103基因可以编码一种分泌肽,可抑制MC1R与ASIP的拮抗作用,促进真黑素的产生。
在狼与家犬的E基因座上有7个等位基因,e1-3、eA、E、EG和Em,按顺序显性依次递增。其中e1、E、Em在家犬中非常常见,可能出现较早,而e2、e3、eA却不那么常见(这里只讨论常见的几个等位基因)。
E基因是该基因座的野生型,编码有功能活性的MC1R与真黑素,K基因座与A基因座上的基因都可以能正常表达。
e1基因是一种广泛存在于各种家犬品种中的功能缺失突变,为MC1R启动子区域的916位核苷酸由C变为T,从而使MC1R蛋白的第306个氨基酸由精氨酸变为终止密码子,从而使MC1R蛋白缺失11个氨基酸。该突变抑制真黑素产生,形成奶油色/隐性红的毛色,并且该毛色有较大变异范围,主要原因与15号染色体上的一个CNV(拷贝数变异)有关。

Em基因由MC1R基因的第706位核苷酸由A变为G,使该蛋白的第264个氨基酸由甲硫氨酸变为缬氨酸而形成。该突变会上调家犬吻部短MC1R表达水平,使得吻部产生真黑素形成黑色的吻部。然而这种黑色吻部或被称为黑色面具的表型只在某些遗传背景上可见。

在许多哺乳动物中,MC1R的显性等位基因编码纯黑色毛发,而对于家犬和狼来说,MC1R的等位基因只是决定是否产生黑色素,而黑色毛发的表达主要是由K基因座编码。
A基因座
狼与家犬的A基因座表型很多样,是由于存在多种独立调节的且表达时空各不相同的ASIP异构体形成的。每个ASIP异构体都有一个独特的启动子和5‘非编码第一外显子。其中腹面启动子(VP)异构体只在腹部体表表达,使腹部毛色淡化。而毛发周期启动子(HCP)异构体只在毛发周期的某些阶段表达,产生贯穿背部的带状深浅色素的毛发。第三种异构体则不参与毛色变化。VP和HCP分别位于基因组的g.23335019和g.23378834。根据这些启动子上下游区域结构变异区分了VP的两个单倍型(VP1和2)和HCP的五个单倍型(HCP1~5),在家犬中分离出五种ASIP被毛表型。这5种表型分别被称为黑背(BB)、黑鞍(BS)、刺鼠色(AG)、阴影黄(SY)和显性黄(DY),按顺序显性依次递增。

AG刺鼠色(VP2-HCP2)是祖先表型,也就是典型的狼的毛色,有浅色腹部,背部毛杆底部到顶端有真黑素或真黑素与类黑素条纹。
SY阴影黄(VP2-HCP1)的毛发周期中ASIP表达量上升,比AG有更多类黑素,毛色通常为均匀的黄色,有黑色毛尖。
BS黑鞍(VP1-HCP4)与BB黑背(VP2-HCP3~5)都在HCP处有表现为ASIP功能丧失的单倍型,BS的VP1比BB的VP2的ASIP1活性更高,产生更多类黑素,使得犬只黄色毛发面积更大,黑色毛发在背部形成马鞍状区域。BS的表现具有渐进性,因此BS与BB幼犬一般难以区分,而随着犬只成熟,类黑素的分布扩大,黑背与黑鞍犬只才容易区分。
DY显性黄(VP1-HCP1)是由于背部与腹部ASIP高表达导致,毛色呈均匀的黄色,色调变化范围大,但具体机制尚不明晰(可能有其他基因座参与修饰或者由于基因剂量变异造成)。
由于A基因座是E基因座的下位基因,因此A基因座的基因型只会影响在E基因座至少有一个E或Em等位基因的犬只毛色
还有第六种罕见的A基因座表型,被称为隐性黑(recessive black),由两个隐性ASIP等位基因 "a "的拷贝形成,该变体是由ASIP第4外显子中96位的精氨酸变为半胱氨酸引起,会导致ASIP1失活而产生黑色毛发。

在狼身上存在VP1与VP2,但HCP只有HCP1,HCP2,却没有HCP3~5。因为HCP3~5都不会使背部产生类黑素而导致背部为纯黑色,很明显这种表型在狼身上并不存在。

以下为两几只狼A基因座的VP与HCP基因型:
VP1-HCP1/VP2-HCP2 (DY/AG)

VP2-HCP2/VP2-HCP2(AG/AG)

K基因座
狼和家犬的黑色毛发主要由K基因座调控。与A基因座一样,K基因座是E基因座的下位基因,因此K基因座的基因型只会影响在E基因座至少有一个E或Em等位基因的犬只毛色。K基因座的三个等位基因分别为ky、kbr和KB,按顺序显性依次递增。
KB基因是由于CBD103中一个3bp的框内缺失形成,导致第23位甘氨酸缺失。从而使CBD103DG23和ASIP竞争与MC1R的结合位点,负责稳定的真黑素的表达。

kbr基因会导致很多犬种的毛发呈现虎斑色,其斑纹毛色由不规则的深浅不一的类黑素和真黑素条纹组成。而在真黑素背景下是看不到虎斑色的,所以只有SY(VP2-HCP1)与DY(VP1-HCP1)个体上才能观察到虎斑表型,而对于BS(VP1-HCP4)与BB(VP2-HCP3~5)犬只只有腹部或身体末端有虎斑。虎斑表型变化范围很大,但具体机制未知。区分kbr与ky基因的遗传变异尚未被描述,但被认为是影响基因拷贝数的结构变异 。

ky是祖先型等位基因,不影响ASIP与MC1R的活性,不会对狼和家犬的原有毛色产生影响。
CBD103基因属于β-防御素基因家族,该基因在家犬与狼的皮肤与呼吸道中表达,编码由中性粒细胞(neutrophils)产生的哺乳动物抗菌肽,在先天性免疫中起作用,保护上皮细胞抵御病原体。而β-防御素基因在其他物种中没有已知的与色素沉淀相关的过程,因此CBD103基因与家犬与狼等物种毛发颜色的关系可能显示出色素沉淀与免疫的潜在联系。
在对于狼的K基因座基因型与表型描述中,黑色毛发的狼基因型为KB/ky与KB/KB,典型的灰色毛色的狼为ky/ky。

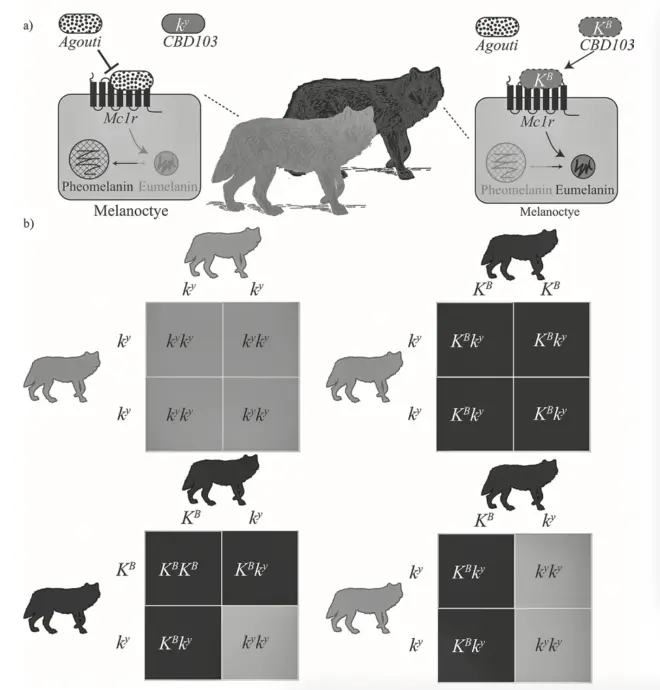
1.祖先野生型CBD103(ky)使Agouti-Mc1r基因正常作用,Agouti抑制Mc1r功能,细胞产生类黑素,真黑素合成受抑制 灰色被毛。2. 三个核苷酸缺失的突变型CBD103基因(KB)导致替代配体去竞争受体位置,阻止Agouti功能,产生真黑素,导致黑色毛发显性遗传。 图b为不同K基因座位点基因型的狼之间的交配Punnet方格显示了K基因座的孟德尔遗传模式。每个方格中的四个方格显示了可能的基因型和后代的毛色。
家犬与狼还有诸多基因座对毛色产生影响,这里暂时不作讨论。
黑狼KB等位基因的演化史与多效性功能探究
对于狼来说,灰色是其最典型的毛色,也符合大多数人对于狼的印象,它们并非单一的灰色,其腿部、胸腹部有浅色毛发。但在北美,狼的黑化频率很高,很多地区的种群中的黑化个体甚至接近一半,尤其在西部地区。而在加拿大东部与五大湖地区黑狼则不太常见。在北美北极地区,狼的毛发基本为白色。(灰色毛发的狼随着年龄增长导致细胞色素减少或面临生理压力时其毛发也有可能变为奶油色或白色,而黑色毛发的狼会变为银色或白色)。

而在旧大陆,黑狼在可靠的文献记录中非常罕见,从19世纪开始可以找到零星报道,如今旧大陆的野生黑狼通常出现在狼与家犬有杂交的种群中。而对于国内一些圈养狼中出现的黑狼,个人推测基本上为进口的原产于北美的狼或北美狼与本土狼杂交造成的,而非纯种的本土狼。




早在1880年黄石公园一位黄石公园第二任园长诺里斯(Philetus W. Norris)在做当年年度报告时,就描述过一种介于灰色的布法罗狼(buffalo wolf)与郊狼之间的黑褐色犬科动物,在公园中很常见。个人猜测,他对于该物种的描述可能就是指的黑化的狼,当时他很可能把灰色毛发与黑色毛发狼当成两个不同的物种。

在1939年至1941年间,第一个在野外研究狼的博物学家——国家公园管理局阿道夫·穆里(Adolph Murie)对麦金利山国家公园(后被更名为德纳利国家公园)对野生狼进行了生态学研究,并在他1944年的专著《麦金利山的狼》(The Wolves of Mount McKinley)中描述了狼毛色的多样性,并推测原因可能和野外狼与家犬的杂交有关。

在之后的一些研究中也发现了黑狼表型在种群中的高频率现象,如在20世纪40年代至21世纪初对贾斯帕国家公园及其周边的狼的观察中发现黑狼在种群中的频率通常要高于50%,部分时段甚至可达到80%。同样在黄石国家公园,黑狼在种群内的频率也非常高。

在2007年,有学者使用基因组连锁扫描(genomewide linkage scan)的方法,对拉布拉多犬和灵缇犬杂交产生的黑色、虎斑色与黄色毛发的后代进行分析,并对多个标记进行孟德尔遗传规律的验证,发现这些犬只的毛色转换由K基因座控制,并得出了三种等位基因的显隐性关系,即黑 (KB) >虎斑 (kbr) > 黄 (ky)。研究结果也将K基因座定位于家犬的16号染色体上,并且将KB突变映射到16号染色体远端遗传标记REN292N24和FH3592之间12 Mb间隔的区域。最后也提出了两种K基因座作用模型 :第一种是K基因是Agouti基因的上位基因并抑制后者的功能。或者其产物作为Agouti mRNA表达的负性调节因子,抑制其表达。或作为翻译后抑制剂,降低 Mc1r(受体)处有活性的Agouti蛋白(胚体)的水平;第二种是K基因产物直接作用于MC1R,从而刺激真黑素信号通路的活性,间接抵消Agouti蛋白的作用。最终的结果都是促进真黑素合成,使家犬呈现黑色毛发。
同年,Candille等人的研究团队基于生化和细胞实验揭示了KB基因使家犬毛色变黑的分子机制。由于先前的研究已经将KB突变定位到16号染色体的一个区间内,学者使用基于连锁的方法来缩小关键区间,并通过对成熟编码区测序,发现了与KB基因相关的几个多态性。在排除了其他基因已知的上位效应对表型的影响后,他们发现第23位甘氨酸缺失与KB突变完全连锁不平衡(一起遗传),从而它们确定了KB突变的位置,这种CBD103的这种框内缺失(CBD103ΔG23)正是KB突变。研究者还利用人工合成的CBD103和CBD103ΔG23蛋白去分别测试与Agouti与MC1R的互作,CBD103ΔG23能够更有效地与Agouti蛋白竞争对Mc1r受体,从而有利于真黑素产生,从而调节家犬毛色。
到了2009年,Anderson等人的团队发现KB突变也会导致狼的毛色呈现黑色,并发表了对KB等位基因的演化史的研究,他们通过对32只北极狼和15只无血缘关系的黄石狼以及12只家犬中的相关片段进行了测序并进行单倍型分析,发现狼K基因座相关片段的连锁不平衡模式与家犬相似,及它们的这个区域的遗传结构与演化史可能较为相似。扩展单倍型纯合性(EHH)分析也表明KB经历过近期的选择性清除(由于KB是有利突变,该突变受到正向选择而趋于固定,而与之一起遗传的中性位点也会随着有利突变的固定而随之固定下来,取代原有位点的多态性,因此在一段时间内KB单倍型会呈现出高频率,低遗传多样性的模式)。研究者还基于CBD103核心区构建了一个简易的邻接树,通过系统发育分析表明KB突变发生在单一物种中,随后通过杂交出现在家犬、狼与郊狼身上。他们通过分子钟的方法估计得该变体至少有约47000年的历史(有95%的概率该突变发生在约13000~121000年间的某个时间点),并推测携带该变体的家犬随着美洲原住民在约12000~14000年前到达北美,并在约500~14000年前通过与狼杂交将KB基因引入北美狼种群。学者还推测黑狼在森林地区有选择优势,并认为狼的毛色与其栖息地有很强的相关性。这种突变从家畜引入野生种群,并丰富了野生种群的基因库,使野生种群能更好地适应环境。

从事该研究的学者也提到相同的KB变体至少三次进入野生犬科动物种群,即进北美狼、意大利狼与郊狼,但黑色毛发喜马拉雅狼的情况尚不明晰。但也有学者依据狼的捕猎习性认为,由于狼是追逐型猎手,经常活跃在开阔显眼的地方追踪猎物,并不依靠在夜间伏击狩猎,因此所谓黑狼在森林中的隐蔽色可能不是对其生存有利的重要因素。20世纪人类对狼的狩猎活动中黑狼可能会更容易被发现从而受到选择压力。一些学者也提出苔原地区的黑狼在夏季可能会容易过热,而白狼则更容易耐高温(个人感觉脑洞大开了真是)。
一些学者认为应该纳入对美东地区犬科的研究来获得更可靠的结论,他认为KB还有可能源于北美东部地区的黑色犬科动物(Canis niger,C. rufus以及C. lycaon),并在威斯康星冰期(11000~18000年前)渐渗进入狼(C. lupus)体内。而研究团队回应道这样的研究最多只能丰富他们得出的结论,因为已经有几个独立的证据表明家犬的KB比样本狼的更古老,家犬的KB也有相对较高的多态性且在全球分布更广,因此KB起源于美东地区类狼犬科动物并扩散到北美狼以及世界各地家犬中的假设是站不住脚的。
由于KB基因是一种有益突变,且KB单倍型在近期经历了选择性清除,因此研究人员对其适应性也产生了兴趣。为了更好地理解该基因的功能和作用,研究人员进一步对KB基因进行了探究。先前提到有学者认为黑色毛发可能作为在森林地区的一种隐蔽色,这个观点在提出时就有人产生质疑。一些学者则将注意力放在KB基因的多效性作用上,即KB基因所带来的黑色毛发可能不会直接带来适应性优势,而是通过影响其他的表型来提供生存优势。
2011年,Coulson等人的研究团队将群体遗传学与数学建模方法相结合,280只狼进行了采样,使用积分投影模型(IPMs,广泛应用于生态学、演化生物学和自然资源管理等领域,应用于预测种群动态、生活史策略、密度制约、环境过滤等方面)对黄石国家公园对狼展开生态学研究。结果发现杂合黑狼(KB/ky)要比纯合黑狼(KB/KB) 纯合灰狼(ky/ky)有更高的年存活率与年繁殖率,也有更长的世代长度(母亲到其后代的平均时间间隔),其终身繁殖成功率也是最高的。而纯合黑狼(KB/KB)在各方面都是最差的,可能这也是该基因型频率本身也非常低的原因,在种群中很罕见。其结果也说明黑色毛发可能并不会带来直接的选择优势,也与之前对隐蔽色的质疑相呼应。作者推测KB突变的选择优势可能与该其他功能有关(即多效性),如KB突变可以在细胞免疫中发挥作用。黄石国家公园的黑狼也存在着平衡选择的现象(杂合子适合度最高,从而维持该基因座的多态性)。
2013年,Stahler等人利用长达14年的黄石国家公园狼长期研究数据,使用多变量混合效应模型评估了狼本身不同性状和生态因素对繁殖雌性灰狼的繁殖情况(产仔数和存活率)的相对影响。结果发现灰色雌狼比黑色雌狼的繁殖成功率更高。雌性杂合黑狼的产下的幼崽年存活率比雌性纯合灰狼要低25%。而KB又可能提高黑狼的免疫力。学者并将其解释为免疫与繁殖投入的能量平衡/权衡(trade off),他们推测KB基因可能为杂合黑狼提供了更强的免疫力,而它们在免疫相关的能量投入的上升可能会增加抚养幼崽的成本。
在2014年,Hedrick等人使用Coulson团队的数据,并根据假设适合度值,计算KB基因的预计频率随时间的变化,并与实际频率进行比较。结果证明了杂合黑狼又很强的杂合优势,其适合度高于纯合灰狼。作者也提到了黄石狼种群中存在负选型交配(即倾向选择与自己表型不同的异性结为配偶,黑狼通常会与灰狼形成配偶)。同时作者也反驳了黑色毛发带来的隐蔽性优势,也正如他在2009年对Anderson等人的研究提出的质疑。
2015年,对伊朗西部的黑狼进行了线粒体DNA、微卫星以及形态学分析,发现样本中2只黑狼在过去的一代或两代代中没有杂交迹象。作者推测伊朗西部有黑色毛发的狼并不一定是近代与家犬杂交造成的基因污染的结果,可能是在野生狼中自然形成的,也有可能是与古代流浪狗杂交导致的。这与意大利的那些由于近期杂交而形成的黑狼不同(而在2004年一篇对一只意大利黑狼的微卫星分析也得出了与这次伊朗狼相似的结论)。
在1995年至2015年在黄石国家公园记录的狼的261次交配中,63.6%是灰狼和黑狼之间的交配。2016年Hedrick等人探究了黄石狼的负选型交配模式,他们首先分析了这21年间的交配数据,并提出了一个负选型交配模型,同时探讨负选型交配的潜在影响,并将估计值与观察值进行比较与分析。结果显示在杂合优势的前提下,黄石狼的负选型交配可以更有力地解释当地狼毛色多态性维持的原因。并且通过与其他物种的数据进行比较,发现狼的负选型交配是哺乳动物中唯一被文献记录的案例,也是脊椎动物中唯一被记录的自然发生的基因多态性案例。而这对于其他一些物种来说通常与基因倒位、人工选择或环境因素有关,并不普遍。正是因为黄石国家公园的独特性,使得在当地可以对接近自然状态的狼种群进行充分的生态观察与种群监测,才能得出这一结论。正如世界顶级狼专家大卫·梅奇(L. David Mech)所说:“黄石公园是世界上观察和研究狼的最佳地点”。
2017年,Cassidy等人通过对黄石国家公园中狼的个体行为观察,对狼群之前的互动进行了评估,并将毛色纳入分析。结果发现黑狼在与其他狼的攻击性互动中表现出的攻击性要低于灰狼,并且对皮质醇的检测结果表明灰狼的皮质醇水平高于黑狼。结合先前对于家犬毛色与基础皮质醇水平的研究,学者推测K基因座的多效性会影响狼的皮质醇激素分泌,降低黑狼糖皮质激素,使得黑狼的基础皮质醇水平低于灰狼,进而影响到狼的行为。
由于2009年Anderson等人团队的研究采样比较有限,KB等位基因的演化史细节,如有从家犬到狼的引入事件到底有几次、发生的时间和地理来源仍然未知。到了2018年,Schweizer等人设计了一个杂交捕获阵列,对北美洲多个种群的狼和20个家犬品种进行了这些区域的测序,评估了核苷酸和单倍型多样性模式、连锁不平衡衰减以及种群间遗传分化的层次模式,并评估了KB等位基因在每个种群样本中的可能起源时间。结果发现K基因座受到选择压力,出现了强烈的选择性清除迹象(有优势的KB在种群中趋于固定,周围与其连锁的一些SNP(单核苷酸多态性位点,包括中性位点)会通过搭车效应随之固定下来,取代原有的SNP位点,使含KB的单倍型遗传多样性下降,但频率升高。由于KB没有完全取代ky,表示KB纯合可能有某种致死机制,该基因型的个体也非常罕见。对于K基因座的扩展单倍型纯合性(EHH)分析显示,相对于家犬,狼的KB单倍型有更广泛的纯合性,也符合选择性清除的情况。基于种群统计数据的结果显示,育空地区狼种群的KB单倍型多样性最高,其次是西北地区,而样本量最大的黄石地区则是最低的(虽然这个从3个不同地区引入的种群在其他方面有较高的遗传多样性),显示出育空和西北地区可能最接近引入事件发生的地点。而通过模型对等位基因频率的推演却排除了之前假设的KB基因的致死效应,显示KB纯合个体数量少可能是自然选择的结果。基于KB单倍型构建的邻接树也显示了北美狼中的KB等位基因的渗入只发生过一次(说明当时人口少,家犬和狼互动机会少,只有一次引入事件传播并流传下来。或者引入世界发生过多次,只有一次得以流传至今),而意大利狼中的KB基因相对于北美狼来说是独立起源的。对于引入事件发生的时间都估计结果显示,样本种群中最古老的引入事件发生的约1598~7248年前的育空地区。因此唯一成功流传下来KB等位基因引入事件可能发生在加拿大北极地区,此后迅速蔓延到整个大陆,使其他狼种群的KB单倍型多样性降低。该事件是最近发生的,这是脊椎动物中已知的传播速度最快的适应性变体的之一,这可能与狼强大扩散能力有关。


研究者对2009安德森等人构建的KB等位基因的演化与传播模型的矫正
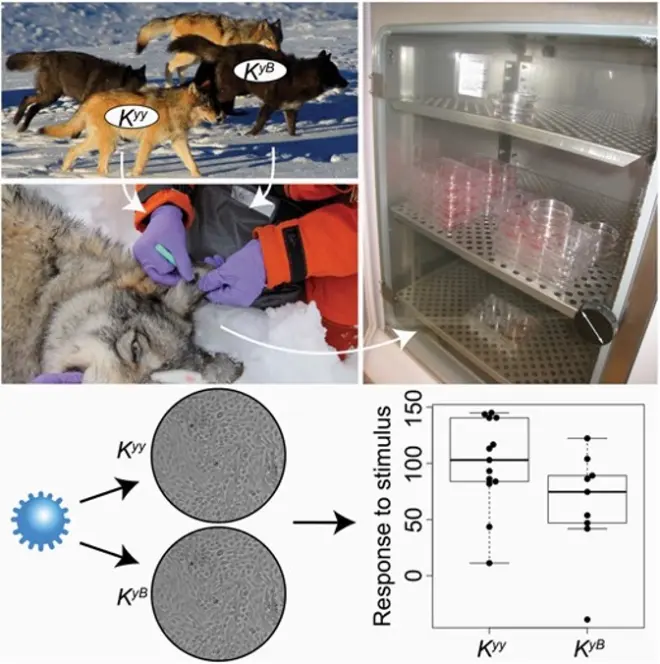
由于K基因座蛋白是β-防御素家族抗菌肽的成员,基于先前对于CBD103的相关研究,人们对其多效性作用的推测大多数着眼于免疫。但KB等位基因对于狼免疫方面的具体影响仍然未知。先前的研究中发现了黄石国家公园K基因座处于平衡选择状态,并且当地食肉目物种密度很高,有众多犬瘟热等病毒等潜在宿主,易于在狼种群中传播。于是在2021年,Johnston等人基于黄石国家公园犬瘟热的流行情况,提出了狼KB等位基因通过影响整个转录组对病毒感染的基因表达反应而对免疫力产生多效性的假设。他们先确定了北美狼中CBD103表达最高的组织和细胞类型,再用分子杂交检测不同细胞的基因型,对ky/ky个体进行永生化处理,之后用CRISPR/Cas9技术将ky/ky中引入KB,建立KB/ky与ky/ky的细胞系。之后分别用聚胞嘧啶酸(polyI:C,TLR3的激动剂)与活的犬瘟热病毒的反应,通过转录组测序观察基因表达情况。然而结果显示不同基因型的细胞系中CBD103表达没有明显区别,实验数据并没有为CBD103基因型改变角质细胞对polyI:C或CDV反应的基因表达水平这一假设提供强有力的支持。研究者推测,CBD103基因型可能通过其他未知的机制影响免疫力,此次研究样本也比较少,未来需要扩大样本进行进一步研究。当然,即使他们的假设成立,也可能因为体外细胞系的局限性而得不到结果(细胞系通常在培养皿中生长,缺乏活体环境中复杂的相互作用。可能会导致细胞的生长和代谢方式不同于活体情况,从而产生偏差)。
在2013年,Ollivier等人对旧石器时代晚期(约公元前12000)的68只不同犬科动物(66只类狗形态,2只类狼形态)进行古DNA分析,发现约在公元前11000年~公元前8000年之间的欧洲家犬中就已经存在。而在2022年Bergström通过对多地的古代狼基因组进行测序,发现在14000前西伯利亚Tumat的一只古代狼(或者形态上接近狼狗杂交)中发现了CBD103三个碱基的缺失,且为杂合,很可能是黑色毛发的个体,这是迄今为止最早的关于CBD103 3bp缺失的证据。研究者认为这个证据让KB起源于狼的可能性提升,并且可能很早就在狼种群中低频存在。但由于其年代(晚于家犬被驯化的时期)也不能排除KB起源于家犬,并通过杂交从家犬杂交渗入狼种群,当然也不能排除KB突变可能有多次独立起源(之前也提到过Schweizer等人在18年的研究中建立的K基因座NJ树显示意大利狼的KB和北美狼的KB是独立起源的)。
2022年,Cubaynes等人探究了黄石国家公园狼的毛色与犬瘟热病毒爆发的关系。他们通过构建模型来评估CDV对黑狼个体和种群水平的影响,并利用个体生活史和毛色数据对当地种群展开分析。结果显示虽然没有单一的证据可以直接证实“北美黑狼的频率由CDV爆发的频率决定”这一假设,但是多个证据线的综合分析表明该假设可能是正确的。犬瘟热爆发的频率对狼的KB基因频率产生了选择压力,但这种选择压力只在特定环境下才会有杂合优势(类似于人类镰刀型细胞贫血症,在疟疾盛行的地方更容易生存,而在其他地区反之)。当疾病流行时,杂合优势,非选型交配策略(即黑狼与灰狼倾向于互相配对)使得种群将有更高的平均适合度。
通过以上对于KB等位基因的研究,人们可以了解到KB等位基因的演化史,该变异可能源自于家犬,并随着美洲原住民迁徙到北美之后通过杂交进入当地狼种群中,如今北美狼体内的KB基因最可能源自数千年前北美西北部育空地区附近。而最近的研究证据显示KB等位基因可能在14000年前的古代西伯利亚狼中就已经存在。然而,关于KB基因究竟起源于狼还是家犬以及是否有多次独立起源的问题,仍需要更多的研究来解答。此外,KB等位基因在狼种群中受到选择压力,并且出现了强烈的选择性清除迹象。研究表明,KB等位基因可能与免疫力有关,但对于其在狼免疫方面的具体影响仍不明晰,需要进一步研究去探索。在研究过程中也发现了在黄石国家公园,狼种群的毛色与当地犬瘟热的流行存在关联,犬瘟热病毒爆发可能对狼的KB基因频率产生影响,但这种选择压力可能在特定环境下才会表现出杂合优势。总体来说,KB等位基因在狼和家犬中的演化和功能研究仍然在不断深入。这些研究有助于我们更好地理解黑化狼的起源和适应性优势,以及在自然环境中的演化过程。然而,仍然有许多未知因素需要进一步探索和证实。
白狼的毛色遗传学与演化起源
除了对于黑色毛发的狼的相关研究,对于白色毛发狼的研究也得到了一些非常有趣的结果。
在2021年,Bannasch等人揭示了ASIP的遗传变异是如何影响家犬的毛色着色模式。他们发现,Agouti的遗传模式是由两种模块化启动子引起的,即腹面启动子(VP)异构体和毛发周期启动子(HCP)异构体,这两种异构体组成的七种单倍型的不同排列组合方式对应着五种毛色类型(具体机制可看前文)。研究团队通过比较18只纯合子狗(针对VP和HCP的结构变异和编码序列)和10只现代灰狼的单倍型。发现AG(VP2-HCP2)与灰狼相似,而DY(VP1-HCP1)与SY(VP2-HCP1)与埃尔斯米尔岛与格陵兰的北极狼单倍型相似。狼的白色被毛代表浅色的类黑素。北极狼的VP HCP64kb编码序列中只有一个多态性位点,其他位点完全相同,而北极狼仅通过6个单核苷酸变异与DY单倍型进行区分。结果说明,没有近期基因流动情况下,家犬的显性黄色毛发(DY)与北极狼的毛色有共同起源。研究者又通过最大似然法构建系统发生树,对家犬、灰狼和其他八个近源犬科物种进行了进一步的ASIP单倍型的演化起源研究。在VP树中,所有的家犬和狼的系统发生关系与物种本身的演化关系相对应。但是HCP树中,DY和SY的家犬与北狼聚在一个单独的支系中。研究者确定了ASIP基因中VP和HCP的派生等位基因,派生等位基因HCP2在核心类狼物种(wolf-like,如狼、胡狼、郊狼、埃塞俄比亚狼等)中具有9个特定的SNV变异,而在DY家犬HCP1中没有这些变异,这个单倍型中存在一段SINE插入(一种专座元件),这也就说明HCP1单倍型可能在200万年以前其他类狼物种之前就存在了。VP1的历史超过5万年,而HCP1则有超过200万年的历史。则结果说明HCP1可能来源于已灭绝的犬科动物的幽灵血统,并在更新世晚期通过杂交引入到狼种群中。研究者将对 VP 和 HCP 单倍型的分析扩展到45只北美狼和23只欧亚狼,发现(VP1-HCP1)单倍型组合主要出现在北美北极地区,与白色被毛分布一致,欧亚地区没有观察到。还确定了一个祖先HCP1单倍型变体HCP1A, (VP2-HCP1A)组合存在于西藏内蒙高海拔浅色狼中。(VP1-HCP1)单倍型组合主要出现在北美北极地区,与白色被毛分布一致,欧亚地区没有观察到。还确定了一个祖先HCP1单倍型变体HCP1A, (VP2-HCP1A)组合存在于西藏内蒙高海拔毛色较浅的狼中。狼种群中的VP1 和 HCP1可能在扩散过程中通过与其他物种的基因交流获得,由于适应更新世与现代的北极环境而流传下来,在塑造家犬和现代狼的遗传多样性方面发挥了关键作用。


参考资料
[1] Brancalion, L., Haase, B., & Wade, C. M. (2022). Canine coat pigmentation genetics: a review. Animal Genetics, 53(1), 3-34.
[2] Wolf Coat Color Genetics. (n.d.). Www.sheilaschmutz.net. Retrieved July 31, 2023, from https://www.sheilaschmutz.net/Canid/WolfColorGenetics.html
[3] Smith, D. W., Stahler, D. R., & MacNulty, D. R. (Eds.). (2020). Yellowstone wolves: science and discovery in the world's first national park. University of Chicago Press. The K Locus: Rise of the Black Wolf
[4] Gipson, P. S., Bangs, E. E., Bailey, T. N., Boyd, D. K., Cluff, H. D., Smith, D. W., & Jiminez, M. D. (2002). Color patterns among wolves in western North America. Wildlife Society Bulletin, 821-830.
[5] Norris, P. W. 1881. Annual report of the superintendent of the Yellowstone National Park to the Secretary of the Interior for the year 1880. Washington, DC: Government Printing Office
[6] Murie, A. (1944). The wolves of mount McKinley (No. 5). US Government Printing Office.
[7] Kerns, J. A., Cargill, E. J., Clark, L. A., Candille, S. I., Berryere, T. G., Olivier, M., ... & Barsh, G. S. (2007). Linkage and segregation analysis of black and brindle coat color in domestic dogs. Genetics, 176(3), 1679-1689.
[8] Candille, S. I., Kaelin, C. B., Cattanach, B. M., Yu, B., Thompson, D. A., Nix, M. A., ... & Barsh, G. S. (2007). A β-defensin mutation causes black coat color in domestic dogs. Science, 318(5855), 1418-1423.
[9] Randi, E., & Lucchini, V. (2002). Detecting rare introgression of domestic dog genes into wild wolf (Canis lupus) populations by Bayesian admixture analyses of microsatellite variation. Conservation Genetics, 3(1), 29-43.
[10] Anderson, T. M., vonHoldt, B. M., Candille, S. I., Musiani, M., Greco, C., Stahler, D. R., ... & Barsh, G. S. (2009). Molecular and evolutionary history of melanism in North American gray wolves. Science, 323(5919), 1339-1343.
[11] Hedrick, P. W. (2009). Wolf of a different colour. Heredity, 103(6), 435.
[12] Harcourt, A. H. (2009). White wolves can stand the heat. Science, 324(5931), 1141-1143.
[13] Rutledge, L. Y., Wilson, P. J., Kyle, C. J., Wheeldon, T. J., Patterson, B. R., & White, B. N. (2009). How the gray wolf got its color. Science, 325(5936), 33-34.
[14] Barsh, G. S., Anderson, T. M., Vonholdt, B. M., Candille, S. I., Musiani, M., Stahler, D. R., ... & Wayne, R. K. (2009). Response—How the Gray Wolf Got Its Color. Science, 325(5936), 34-34.
[15] Doyglas J. Futuyma. (2016) 生物进化 ,第三版. 高等教育出版社.
[16] Coulson, T., MacNulty, D. R., Stahler, D. R., VonHoldt, B., Wayne, R. K., & Smith, D. W. (2011). Modeling effects of environmental change on wolf population dynamics, trait evolution, and life history. Science, 334(6060), 1275-1278.
[17] Stahler, D. R., MacNulty, D. R., Wayne, R. K., VonHoldt, B., & Smith, D. W. (2013). The adaptive value of morphological, behavioural and life‐history traits in reproductive female wolves. Journal of Animal Ecology, 82(1), 222-234.
[18] Hedrick, P. W., Stahler, D. R., & Dekker, D. (2014). Heterozygote advantage in a finite population: black color in wolves. Journal of Heredity, 105(4), 457-465.
[19] Hedrick, P. W., Smith, D. W., & Stahler, D. R. (2016). Negative-assortative mating for color in wolves. Evolution, 70(4), 757-766.
[20] Cassidy, K. A., Mech, L. D., MacNulty, D. R., Stahler, D. R., & Smith, D. W. (2017). Sexually dimorphic aggression indicates male gray wolves specialize in pack defense against conspecific groups. Behavioural processes, 136, 64-72
[21] Schweizer, R. M., Durvasula, A., Smith, J., Vohr, S. H., Stahler, D. R., Galaverni, M., ... & Wayne, R. K. (2018). Natural selection and origin of a melanistic allele in North American gray wolves. Molecular biology and evolution, 35(5), 1190-1209.
[22] Johnston, R. A., Rheinwald, J. G., VonHoldt, B. M., Stahler, D. R., Lowry, W., Tung, J., & Wayne, R. K. (2021). K Locus effects in Gray wolves: experimental assessment of TLR3 Signaling and the gene expression response to canine distemper virus. Journal of Heredity, 112(5), 458-468.
[23] Ollivier, M., Tresset, A., Hitte, C., Petit, C., Hughes, S., Gillet, B., ... & Hänni, C. (2013). Evidence of coat color variation sheds new light on ancient canids. PloS one, 8(10), e75110.
[24] Bergström, A., Stanton, D. W., Taron, U. H., Frantz, L., Sinding, M. H. S., Ersmark, E., ... & Skoglund, P. (2022). Grey wolf genomic history reveals a dual ancestry of dogs. Nature, 607(7918), 313-320.
[25] Khosravi, R., Asadi Aghbolaghi, M., Rezaei, H. R., Nourani, E., & Kaboli, M. (2015). Is black coat color in wolves of Iran an evidence of admixed ancestry with dogs?. Journal of applied genetics, 56, 97-105.
[26] Caniglia, R., Fabbri, E., Greco, C., Galaverni, M., Manghi, L., Boitani, L., ... & Randi, E. (2013). Black coats in an admixed wolf× dog pack is melanism an indicator of hybridization in wolves?. European Journal of Wildlife Research, 59, 543-555.
[27] Cubaynes, S., Brandell, E. E., Stahler, D. R., Smith, D. W., Almberg, E. S., Schindler, S., ... & Coulson, T. (2022). Disease outbreaks select for mate choice and coat color in wolves. Science, 378(6617), 300-303.
[28] Bannasch, D. L., Kaelin, C. B., Letko, A., Loechel, R., Hug, P., Jagannathan, V., ... & Leeb, T. (2021). Dog colour patterns explained by modular promoters of ancient canid origin. Nature ecology & evolution, 5(10), 1415-1423.
[29] Apollonio, M., Mattioli, L., & Scandura, M. (2004). Occurrence of black wolves in the Northern Apennines, Italy. Acta theriologica, 49, 281-285.

