高中化学基础与解法全集(涵盖所有)|长期更新|从零开始拯救所有学渣!

同素异形体
同素异形体的变化属于化学变化,如:灰锡和白锡的变化,同素异形体之间的区别一般体现在物理变化
氧化物
按组成元素分:
1.金属氧化物,如:K2O、CaO、Fe2O3
2.非金属氧化物,如:SO2、CO2、SO3、P2O5
按性质分:
1.成盐氧化物:(1)酸性氧化物,如:CO2、SO3、Mn2O7
(2)碱性氧化物,如:Na2O、CuO
(3)两性氧化物,如:Al2O3、ZnO
2.不成盐氧化物,如:CO、NO
3.特殊氧化物,如:Fe3O4、Pb3O4、Na2O2、H2O2

分散系
1.概念:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物
2.分散系中被分散成粒子的物质叫做分散质,另一种物质叫做分散系
3.根据分散质粒子的直径大小,我们可以把分散系分为以下三种物质:
(以下数字表示分散质粒子的直径大小,单位为nm)
(1) 0~1 为溶液
(2) 1~100 为胶体
(3) 100以上 为浊液
其特性从这个时间点开始可以查看
Fe(OH)3胶体的制备
(1)具体操作:往烧杯中加入40ml蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸腾水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
【提醒】制备胶体实验需要注意:
1.不能用自来水代替蒸馏水,自来水中的离子会使胶体聚沉;
2.当溶液呈红褐色则停止加热,否则加热过度会使胶体沉淀;
3.边加边震荡烧杯,但不能用玻璃棒搅拌,否则胶体会沉淀。
(2)制备原理:
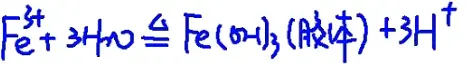
丁达尔效应
当光束通过胶体时,由于胶体粒子对光线散射(光波偏离原来方向而分散传播),可以在垂直于光的路径上看到一条明显的光柱,这现象叫做丁达尔效应。由于溶液粒子大小一般不超过1nm,溶液对光的散射作用很微弱,这样就可以利用丁达尔效应鉴别(不是定义)溶液和胶体
电泳
胶体在外加电场作用下做定向移动(胶粒带电(不是胶体带电,这里有个坑),如Fe(OH)3胶粒带正电,H2SiO3胶粒带负电),这样就可以利用胶体进行工厂静电除尘
聚沉
胶体粒子聚集成为较大的颗粒,形成沉淀从分散系中析出的过程,常见的聚沉方法有:加热、加入电解质、加入与胶体粒子带相反电荷的胶体,生活中这种性质可以用于:制豆腐、工业制肥皂,同时也可以用于解释某些自然现象,如:江河入海口形成沙洲
渗析
由于胶粒半径较大不能通过半透膜,而离子、小分子半径较小可以通过半透膜,用此方法可将胶体提纯,主要可以用于血液透析、净化、精制胶体
电解质与非电解质
1.电解质是指在水溶液或熔融状态下能够导电的化合物;与之相反,非电解质就是在水溶液里以及熔融状态下都不能导电的化合物。
电解质与非电解质的相同之处,在于它们都是化合物。单质、混合物既不属于电解质,又不属于非电解质
2.电解质一定是本身含有离子或能电离出离子的化合物。有些化合物的水溶液能导电,但溶液中的离子不是该化合物自身所电离产生的,故不属于电解质而是非电解质。如:SO2、SO3、CO2、NH3等。但它们与水反应生成的H2SO3、H2SO4、H2CO3、NH3·H2O等能发生电离,是电解质。
3.BaSO4等难溶于水的盐,其水溶液几乎不导电,是因为溶解的量很少,离子浓度很小,但BaSO4溶解的部分能全部电离,并且
BaSO4在熔融状态下能电离,故BaSO4等难溶盐是电解质(碱同理)
强电解质与弱电解质
1.强电解质:在水溶液中(或熔融状态下)能完全电离的电解质
(1) 强 酸 :HClO4(高氯酸)、HI(碘化氢,水溶液叫氢碘酸)、HBr(溴化氢,水溶液叫氢溴酸)、HCl(氯化氢,水溶液叫氢氯酸,俗名叫盐酸)、HNO3(硝酸)、H2SO4(硫酸)
(2) 强 碱 :NaOH、KOH、Ca(OH)2、Ba(OH)2
(3)大 多 数 盐:NaCl、KI、Ca(NO3)2、CH3COONa(醋酸钠)、NH4Cl、BaSO4(难溶于水和是否是强电解质或弱电解质没有关系)等
(4)活泼金属氧化物:Na2O、MgO、CaO、Al2O3
2.弱电解质:溶于水(或在熔融状态下)后就只能部分电离的电解质。
种类:弱碱、弱酸、水(必须是纯水)
3.划分强、弱电解质的唯一标准是看电解质是否完全电离。
4.电解质的强弱与其溶解性无关。
5.电解质的强弱与溶液的导电性没有必然联系,强电解质溶液的导电性不一定强。导电性的强弱取决于溶液中自由移动的 离子浓度/电荷量(重要考点,🤪记!🤪记!🤪记!)
离子方程式【非常重要】
1.离子方程式是指用实际参加反应的离子符号来表示的式子
2.离子方程式的书写步骤:

如果离子在反应中不参与,那么称该离子为旁观离子,在离子方程式中要去除,以显示离子反应的本质,如将HCl+NaOH=NaCl+H2O写成H+ + OH-=H2O,离子方程式不仅表示一个反应式,还表示一类反应式。因而离子方程式可以清楚地表示在离子反应中真正的参与离子。
拆写规律
能拆写成离子的物质必须同时具备易溶、易电离这两个条件,即易溶的强电解质写成离子形式,其他物质一律写化学式。
1.强碱、强酸、易溶盐写成离子形式。
2.单质、氧化物(如CuO)、气体、难溶物(如CaCO3)、弱电解质(弱酸、弱碱、水)一律写化学式

有区别哦👆
特殊情况如下:

鱼找鱼,虾找虾,蛤蟆找青蛙~

实战如上👆
判断离子是否共存
1.溶液颜色:当溶液无色时,有色离子不会大量共存
2.溶液酸碱性条件:
(1)溶液呈强酸性时,与H+反应的离子无法大量存在:OH-、CO₃²﹣、SO₃²﹣、S²﹣、Ac﹣、ClO﹣、AlO₂﹣、F﹣
(2)溶液呈强碱性时,与OH-反应的离子无法大量存在:H+、NH₄+、Mg²+、Al³+、Fe²+、Fe³+、Cu²+、Zn²+
(3)无论是强酸性还是强碱性,皆无法大量共存的离子:HCO₃-(碳酸氢根离子)、
HSO₃-(亚硫酸氢根离子)、HS-(硫氢根离子)、H₂PO₄-(磷酸二氢根离子)、HPO₄²-(磷酸一氢根离子)、HC₂O₄-(草酸根离子)
3.常见的难溶物
(1)难溶物:
SO₄²-与Ba²+、Pb²+
Ag+与Cl-、Br-、I-
CO₃²-、SO₃²-:只有Na+、K+、NH₄+可以大量共存
OH-:只有Na+、K+、Ba²+可以大量共存
(2)微溶物:CaSO₄、Ca(OH)₂、MgCO₃、Ag₂SO₄
注:Ag与上述离子组成的物质按顺序越来越黄
4.离子间发生氧化还原反应不共存:
(1)Fe³+:与S²-、HS-、SO₃²-、
HSO₃-、I-不能大量共存
(2)NO₃-(H+):与S²-、HS-、SO₃²-、
HSO₃-、I-、Fe²+、Br-不能大量共存
(3)MnO₄-(H+)/Cr₂O₇²-(H+)/ClO-(H+):
与S²-、HS-、SO₃²-、HSO₃-、I-、Fe²+、Br-、Cl-不能大量共存
与量有关的离子方程式
1.少量定为1,过量者要多少有多少
2.先写中和,后写沉淀
3.少量者符合化学式比例,过量者不一定
陷阱:多出来的离子要多少有多少,所以不要漏加。CO₂和OH-中CO₂过量生成CO₃²-和H₂O。CO₂和OH-中OH-过量生成HCO²-
SO₂同理。
- 难溶者先沉淀、有剩余再考虑微溶
- 强者先行,弱者靠后
离子方程式正误判断
注意点1:观察该方程式是否能发生
注意点2:观察该方程式是否符合电荷守恒
注意点3:看是否符合拆写规则
注意点4:看方程式中是否有遗漏掉的离子反应
注意点5:看反应物或产物配比是否正确
注意点6:看是否符合题目设定条件,如过量/少量/滴加顺序
氧化还原反应
1.氧化反应:失去电子,化合价升高
还原反应:得到电子,化合价降低
2.氧化剂:帮助别人氧化的物质,本身被还原(得到电子,化合价降低)
还原剂:帮助别人还原的物质,本身被氧化(失去电子,化合价升高)
升失氧化 还原剂 降得还原 氧化剂
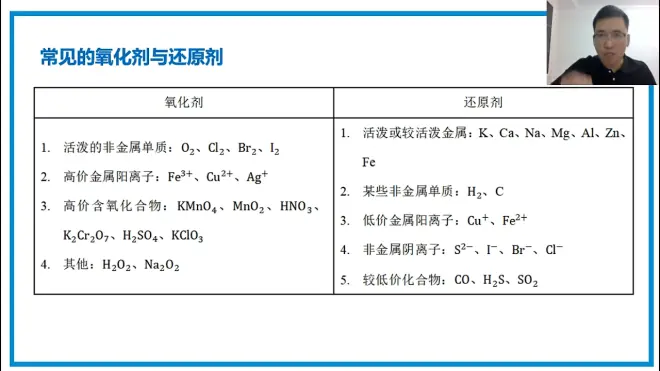
常见的氧化剂与还原剂

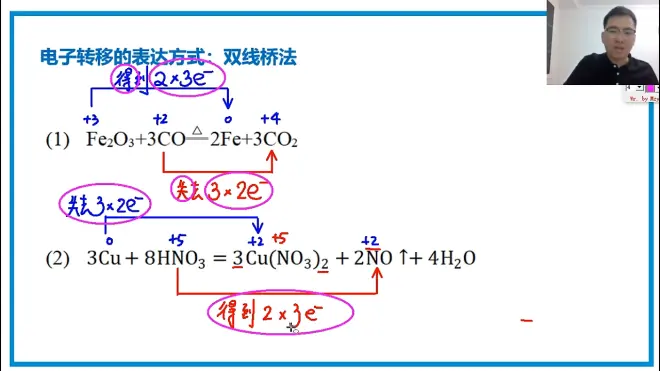
电子转移的表达方式
1.双线桥法:每一条线只针对一个元素,标明失去或是得到来表明电子的得失,写出
A✖B e-来表示在A个离子中每个离子得到或失去了B个电子,一定要注意是否所有的有变元素的元素都发生了电子得失的变化,如下:
本课重点:在你眼中我是谁~你想我代替谁~彼此交换喜悲~爱的人总先掉眼泪~[doge]
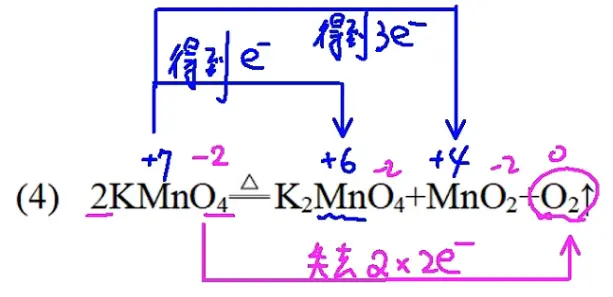
如果一个变元素的元素变为两个化合价,那么打两个箭头,如下的锰哥:
2.单线桥法:线连接的是反应物之间的电子得失,不必标明失去或者得到电子,只用打箭头来标明电子在反应物之间的移动即可,写出
A e-来表示移动电子的数量。
还原性、氧化性的强弱顺序
一般的氧化反应可表示为:氧化剂+还原剂→还原产物+氧化产物
(1)氧化性:氧化剂>氧化产物
(2)还原性:还原剂>还原产物
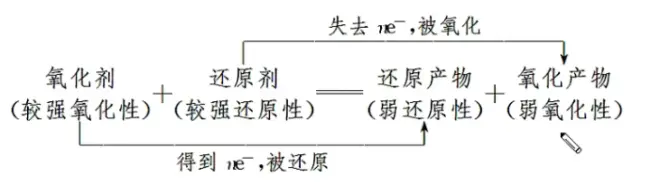
升失氧化 还原剂 降得还原 氧化剂
反应先后顺序:强者先行
(1)同一氧化剂与含多种还原剂(浓度相同)的溶液反应时,首先被氧化的是还原性最强的物质
(2)同一还原剂与含多种氧化剂(浓度相同)的溶液反应时,首先被还原的是氧化性最强的物质
✳还原性顺序:
S²->S⁴+>I->Fe²+>Br->Cl->Mn²+
留点铁锈长绿毛 : 硫碘铁溴氯锰【老师版本】
留点铁修理锰哥 : 硫碘铁溴氯锰【弹幕版本】
Ps:爱选哪个选哪个,根据自己实际情况来
✳氧化性顺序:
>KMnO₄>MnO₂>Cl₂>Br₂>Fe³+>I₂>S【教材范围内就是倒过来的留点铁锈长绿毛,只不过铁变为了三价铁,锰一分为二变为二氧化锰和高锰酸钾】偶尔会出现SO₄²-,它的氧化性位于Br₂和Cl₂之间
【F(氟)拓展资料:全世界不超过十间实验室能完全制备储存并使用单质氟,因为其氧化性非常强,教材中根本没有写有关单质氟的实验,所以氟不在我们的教材范围内,大家只要记住我锰哥最牛逼就好了【doge】】
价态归中规律与歧化规律
1.价态归中规律:同种元素不同价态之间发生反应,元素的化合价只向中间靠拢而不交叉(SO₂与H₂SO₄不能反应,即使它们是有氧化性和还原性,却因为+4价和+6价中间为+5价且不存在+5价的硫,所以SO₂与H₂SO₄不能反应)
2.同一物质、同一价态、同一元素,既被氧化又被还原的反应,歧化反应的特点是氧化剂和还原剂是同一物质
氧化还原方程式配平原则
1.写四样、平四样(标变价、列变化、求总数、定系数)
2.化学方程式:补溶剂
离子方程式:调平电荷
3.看H补水,用O检查
多元素反应类型可以从反应物变为生成物后单个物质变的化合价总数来看,从而做到两者配平,主要还是根据如上口诀(这是快的方法,听不懂的同学可以单单设个x进行计算,但是在电荷配平方面比较麻烦,所以在高中不推荐)
歧化反应类型由反应物推向生成物,由后往前配
氧化性与还原性强弱判断
金属为:K-Ca-Na-Mg-Al-Zn-Fe-Sn-Pb-(H)-Cu-Hg-Ag(除去铂和金的金属活动性顺序表)
这个顺序为金属单质的还原性顺序(逐渐减弱),也是金属阳离子的氧化性顺序(逐渐增强)
非金属为:F₂-Cl₂-Br₂-I₂
这个顺序为非金属单质的氧化性顺序(逐渐减弱),也是非金属阴离子的还原性顺序(逐渐增强)
为展示区别,红色为单质
绿色为离子
蓝色为还原性顺序和减弱
紫色为氧化性顺序和增强
注意:得(失)电子的数目与得(失)电子的能力不同。高氯酸(HClO₄)的氧化性<次氯酸(HClO)的氧化性,但是高氯酸中的氯比次氯酸中的氯化合价要高。这种情况就是化合价要高但是氧化性要弱的例子。含有最高价元素的化合物不一定含有很强的氧化性,比如二氧化碳和铝离子,碳是+4价最高价,却氧化性不强,氧化铝中铝+3是最高价,氧化性却并不强
陌生氧化还原反应方程式书写
1.写出"谁+谁=谁+谁",这里必须通过化合价升降,自行判断产物是什么
2.进行氧化还原方程式的配平,如上【氧化还原方程式配平原则】这里一定要先调平电荷时再看H补水,最后用O检查
这里有个高中知识点,即尿素中N和C的化合价,如图可得出N在尿素中的化合价为-3价
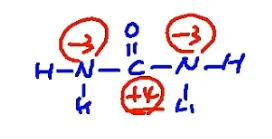
拜托,杰哥的方法真的很好用,不要再墨守成规用初中的方法苦苦设x了各位小伙伴们
社会我钠哥【钠贝勒传】

钠在自然界只有化合态,没有游离态。其实在太活泼,很容易丢失一个电子而形成稳定的钠离子。
钠与含酚酞的水反应会浮在水面上,会逐渐融入水中,使水中产生氢氧化钠,溶液变红。因而可以用:“浮、熔、游、响、红”来描述钠与含酚酞的水的反应(芙蓉这个姑娘有想过红)
钠与酸的反应,比水反应更剧烈

What's up!这么剧烈!O_o
算了,还是Rb(铷)和Cs(铯)更剧烈(直接爆炸)
钠与硫酸铜水溶液会先于水反应而生成NaOH而不与硫酸铜反应(初中党都懂)
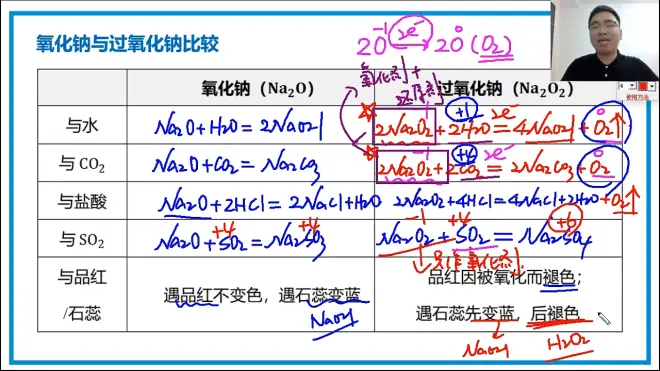
在加热或是点燃条件下,钠金属会生成黄色的过氧化钠

过氧化钠和二氧化硫反应不生成氧气,但和水或二氧化碳反应都会生成氧气

候氏制碱法如上
钠
1.钠单质的物理性质:
(1)颜色:银白色,有金属光泽
(2)密度:ρ(H₂O)>ρ(Na)>ρ(煤油)【因而在煤油中保存】
(3)熔点:<100℃
(4)硬度:质地柔软,轻压变形,可以用小刀切割
2.钠的还原性

钠在在空气中与氧气反应生成氧化钠和过氧化钠,之前【社会我钠哥】中介绍过了
而钠与水的反应前面也介绍过了,不再多提。
3.氧化钠过氧化钠比较

4.碳酸钠与碳酸氢钠
(1)候氏制碱法
先将氨气通入饱和食盐水中,再往其中通入二氧化碳,使溶液中阳离子同时存在铵根离子和钠离子,阴离子同时存在碳酸根离子、碳酸氢根离子和氯离子,然而生成的碳酸氢钠在其中较难以溶解从而析出,收集起来再加热就能够生产出纯碱(碳酸钠)
(2)碳酸钠和碳酸氢钠的热稳定性的套管实验

(3)性质比较

碱性溶液可以溶解油污,因而碳酸钠可以除去餐具的油污

(4)碳酸钠与碳酸氢钠的鉴别

(5)碳酸钠与碳酸氢钠的除杂

焰色试验
1.概念:很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验
2.实验操作:
洗——将铂丝(或光洁无锈的铁丝)用盐酸洗净
烧——将洗净的铂丝(或铁丝)放在酒精灯(或煤气灯)外焰上灼烧,至与原来的火焰颜色相同时为止
蘸——蘸取试样
烧——在外焰上灼烧,并观察火焰颜色
3.有关焰色实验
焰色试验产生的火焰颜色与元素的存在状态无关,如:灼烧钠的单质和化合物时火焰颜色都呈现黄色。
不能用铜丝或玻璃棒代替铂丝,因为铜丝是金属单质,也会有焰色现象,玻璃棒中玻璃含钠或钙或钠和钙,其中的钠或钙或钠和钙也会发生焰色现象,而铂在火的影响下几乎是不会发生焰色反应的。同时,镁、铝,还有铁、铂、镍等都没有焰色反应,所以可以用这些金属中的一些来做为支架。
焰色试验属于物理变化,不属于化学变化。
4.焰色
Li——紫红色 Na——黄色
K——紫色(蓝色钴玻璃下观察)
Ca——砖红色 Ba——黄绿色
Sr(锶)——洋红色 Cu——绿色
李子红了Li——紫红色
盖房子砖红色Ca——砖红色
腮上洋红Sr(锶)——洋红色
呼伦贝尔大草原Ba——黄绿色(黄是形容词,绿是颜色)
氯
1.氯气
颜色:黄绿色 状态:气体 气味:刺激性
密度:比空气大 毒性:有毒性
溶解性:可溶于水,1体积水约溶解2体积氯气
沸点:沸点与气体比偏高、易液化
2.氯气与氢气的反应
【现象】(1)H₂在Cl₂中安静地燃烧
(2)火焰呈苍白色(真的白)
(3)瓶口上方出现白雾(HCl小液滴)
【化学方程式】
Cl₂+H₂=2HCl (条件为点燃)
3.氯气和金属的反应
(1)与钠的反应
现象:产生黄色火焰,冒白烟
化学方程式:2Na+Cl₂=2NaCl (加热)
(2)与铁的反应
现象:产生棕褐色的烟
化学方程式:2Fe+3Cl₂=2FeCl₃ (加热)
(3)与铜的反应
现象:产生棕黄色的烟
化学方程式:Cu+Cl₂=CuCl₂ (加热)
4.配置氯水
(1)在常温下,溶入水中的部分氯气与水发生反应 Cl₂+H₂O=HCl+HClO (= 为可逆符号,必须要写)

这就是可逆符号👆
(2)新制氯水的成分
三分:H₂O>Cl₂>HClO
四离:H+>Cl->ClO->OH-
(3)新制氯水的性质
表现性质:黄绿色、强氧化性
H+:强酸性
HClO:弱酸性,强氧化性
【HClO可以漂白、杀菌、消毒,Cl₂可使湿润的有色布条褪色,不能使干燥的有色布条褪色,说明Cl₂没有漂白性,而是HClO起漂白作用。因而如果在新制氯水中加入紫色石蕊溶液,会先变红,再褪色】
5.久制氯水
(1)反应方程式:2HClO=2HCl+O₂⬆ (光照或加热)
(2)成分:HCl水溶液
(3)性质:有酸性(比新制氯水强),无氧化性、无漂白性
(4)实验室中氯水需现用现配,且避光、密封保存在棕色试剂瓶中
6.氯气与常温下的氢氧化钠溶液反应
化学方程式:Cl₂+2NaOH=NaCl+NaClO+H₂O
离子方程式:Cl₂+2OH-=Cl-+ClO-+H₂O
此反应的应用:
(1)实验室吸收多余的Cl₂
(2)工业制漂白液(84消毒液),有效成分为NaClO,,所以84消毒液中的有效氯为NaClO中的氯元素
7.氯气和冷的石灰乳【Ca(OH)₂】
2Cl₂+2Ca(OH)₂=CaCl₂+Ca(ClO)₂+2H₂O
Ca(ClO)₂为漂白粉、漂白精
漂白粉的起效与失效:
Ca(ClO)₂+CO₂+H₂O=CaCO₃+2HClO(起效)
2HClO=2HCl+O₂⬆(失效)
氯气的实验室制法
1.MnO₂+4HCl(浓)=MnCl₂+Cl₂⬆+2H₂O[加热]
MnO₂+ 2Cl-+ 4H+ = Mn²+ +Cl₂⬆ + 2H₂O[加热]
【第一个为化学方程式,第二个为离子方程式】
2.实验装置

这里尾气吸收装置的反应方程式如下:
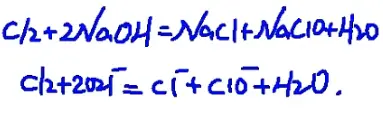
注意:这里除杂装置必须是先除盐酸再除水,饱和食盐水和浓硫酸的顺序不能换。同时,尾气吸收装置要么用NaOH、要么用KOH这些在水中溶解度较高的碱来吸收多余氯气,不要用Ca(OH)₂,因为其在水中的溶解度较小,虽然便宜,但是好好想想是你的钱重要还是你的命重要,要考虑实际效果的。
那么还有个问题,如何将氯气验满,那接下来我们看看聪明的人都是如何做的:
老师这还不简单,把同桌拿过来靠近瓶口,如果同桌立即昏倒,那么则Cl₂收集满
用湿润的淀粉碘化钾(Kl)试纸在瓶口靠近,若试纸立即变蓝,则氯气收集满,因为Cl₂+2Kl=2KCl+I₂,这个生成的碘(I₂)就可以与淀粉发生反应使试纸变蓝。
检验氯离子
和初中完全一样!好耶!
就是加入稀硝酸和硝酸银溶液
氯气的重要性质
1.重要反应方程式
H₂+Cl₂=2HCl (点燃)
2Fe+3Cl₂=2FeCl₃ (加热)
Cu+Cl₂=CuCl₂ (加热)
Cl₂+H₂O=HCl+HClO (可互逆)(制备氯水,新制氯水中HCl有强酸性,HClO有强氧化性)
2.制备方法
(1)实验室制取氯气
MnO₂+4HCl(浓)=MnCl₂+Cl₂⬆+2H₂O (加热)

2KMnO₄+16HCl=2KCl+2MnCl₂+5Cl₂⬆+8H₂O
(2)工业制取氯气
电解饱和食盐水:
2NaCl+2H₂O=2NaOH+H₂⬆+Cl₂⬆ (电解)
物质的量
1.物质的量
(1)概念:表示含有一定数目粒子的集合体,是国际单位制中七个基本物理量之一
(2)符号及单位:符号为n,单位为摩尔(可简称“摩”,符号为“mol”)
(3)计量对象:原子、分子、离子、原子团、电子、质子、中子
2.阿伏伽德罗常数
(1)定义:1mol粒子集合体所含的离子数约为6.02✖10²³。
1mol任何粒子数叫做阿伏伽德罗常数,符号位NA,通常用6.02✖10²³mol-¹表示。
(2)物质的量、阿伏伽德罗常数与粒子数之间的关系n=N/NA。
3.摩尔质量
(1)定义:单位物质的量的物质所具有的质量。符号为M,单位为g/mol或g·mol-¹。
(2)数值:摩尔质量以g/mol为单位时,在树枝上等于该粒子的相对原子质量或相对分子质量。
(3)物质的量、质量和摩尔质量之间的关系:n=m/M。
4.气体摩尔体积
(1)定义:单位物质的量的气体所占的体积,符号为Vm
(2)表达式:Vm=V/n,单位为L/mol或L·mol-¹
(3)气体摩尔体积与气体所处的温度与压强有关
(4)在标准状况下(0℃、101kPa)
气体的摩尔体积约为22.4L·mol-¹
①在标准状况之下,1mol任何气体所占据的体积都为22.4L。
②使用时:物质的聚集状态一定要是气体(可以是混合气),条件必须是标况,不符合以上两点,则不能应用。
阿伏伽德罗定律
内容:同温同压下,相同体积的任何气体(包括混合气体)都含有相同数目的粒子(分子)。
根本公式:PV=nRT (PM=ρRT)
P:压强 V:体积 n:物质的量 R:一个常数 T:温度
这个公式高中教材中没有讲,但是很好用,根据这个公式,可以推导出如下所有初中的结论:

别问杰哥去哪了,问就是P掉了
物质的量浓度
1.定义:以单位体积溶液里所含溶质B(B表示各种溶质)的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
2.表达式:CB=nB/V液
3.单位:物质的量浓度常用的单位为mol/L
溶液中离子浓度的关系与电荷守恒
1.溶液中离子浓度的关系:强电解质在水溶液中完全电离,离子浓度之比等于化学式中粒子的数目(下标)之比
2.溶液中的电荷守恒:电解质溶液中阳离子所带的正电荷总数=阴离子所带的负电荷总数
电荷守恒方程式口诀:阳离子放一边,阴离子放一边,电荷数往前乘
溶液的稀释
字太多了,直接上图

配置一定物质的量浓度的溶液
1.实验仪器:天平、药匙、量筒、烧杯、玻璃棒、容量瓶【要写规格】、胶头滴管
2.有关容量瓶的使用:容量瓶使用前要检查是否漏液。其操作顺序为:
装水盖塞→倒立→正立→玻利塞旋转180°→倒立
容量瓶的模样:

一般情况下如果实验室中没有所需的容量瓶,那么一般选规格最接近所需规格的容量瓶,所以在配置的时候不是想配多少毫升就配多少毫升。
容量瓶的玻璃塞与容量瓶的接触面上较粗糙,主要目的是增加摩擦力防止玻璃塞过分容易落下。
中间部分跳掉了,懒得做笔记了QwQ
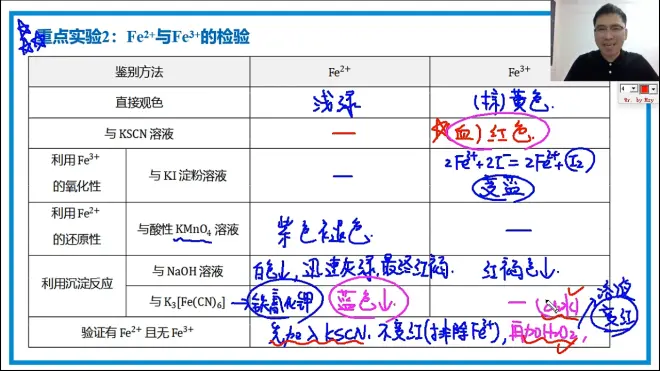
二价铁与三价铁的检验
铁、铜与氯化铁、氯化铜溶液的反应问题

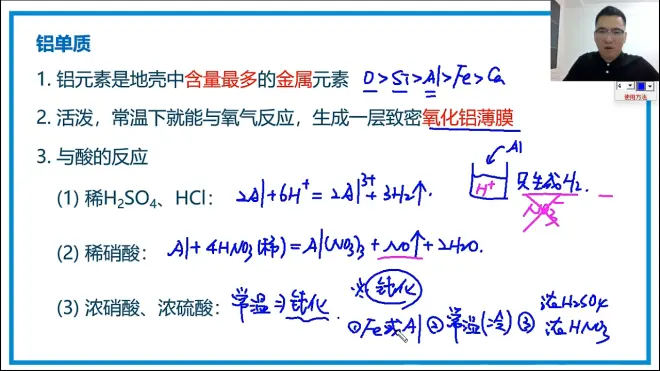
铝单质的性质

铝热反应
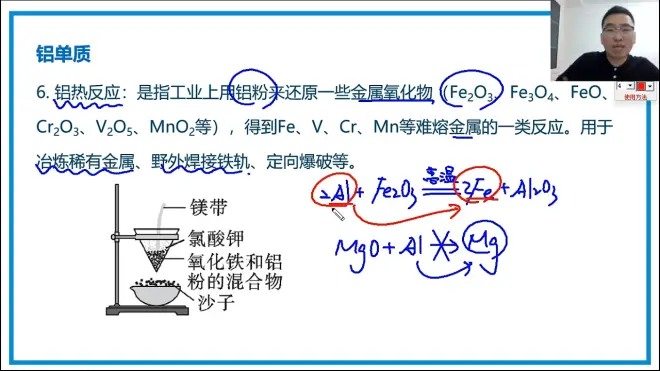
注意,这里面的漏斗只能是纸漏斗,不然高温反应非常剧烈,玻璃渣子炸死你丫的
同时,底下的接盘要装沙子,不然得会儿高温的铁掉下来也会炸掉
氧化铝

氢氧化铝


铝三角plus



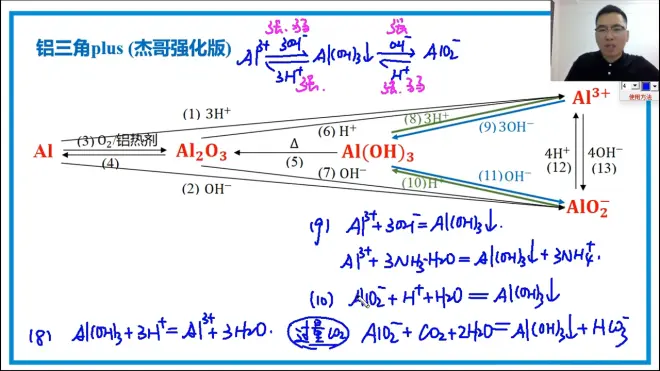
铝及其化合物重要考点
1.两性!两性!两性!
2.用途!用途!用途!
Al:铝合金、航空航天材料
Al₂O₃:耐热材料、炼铝原料、刚玉【宝石主要成分】
Al(OH)₃:净水剂、制酸剂、阻燃剂
可溶性铝盐:净水剂
特殊:钻石为碳,宝石为氧化铝、其它大多数首饰为二氧化硅
经过我在学校上课堂中的学习,目前会跳过一部分内容

卤代反应
解释一部分:试管中有少量白雾是应为有HCl
而水槽中固体析出是因为HCl极易溶于水,溶于水后Cl-离子浓度过大以致NaCl析出。

