泛素特异性肽酶5通过稳定Tu翻译延伸因子调节结直肠癌细胞生长
写在前面
今天推荐的是由苏州中国医学科学院系统医学中心在2019年5月31日发表于Theranostics(IF:8.393,JCR 1区)的一篇文章,通讯作者是Yili Yang教授,研究表明泛素特异性肽酶5通过稳定Tu翻译延伸因子调节结直肠癌细胞生长。
研究背景
泛素特异性肽酶5(USP5)是一种普遍表达的去泛素化酶(DUB)。它已被证明参与了DNA修复、细胞凋亡、炎症和肿瘤细胞生长。然而,USP5在结直肠癌(CRC)中的功能和分子机制仍不清楚。在本研究中,作者研究它是如何影响结肠直肠癌细胞的生长的。
摘要部分
作者进行了基于shRNA的高含量筛选,以确定影响CRC细胞生长的DUBs。用CCK-8试验和异种移植来评估CRC细胞的生长、生存和肿瘤发生。进行RT-qPCR、免疫印迹和免疫组化来定量USP5在CRC组织和细胞系的表达。进行了免疫沉淀和质谱分析,以确定USP5的相互作用蛋白。环氧乙烷追赶法用于评估Tu翻译延伸因子(TUFM)的稳定性。利用双荧光素酶报告试验对USP5启动子进行分析。作者实验发现,USP5在一组原发性CRC组织中高度表达,USP5的增加与临床分期和总生存期的缩短相关。虽然USP5敲除有效地抑制了CRC细胞的生长,但过量表达的USP5促进了CRC细胞的生长,并使其对多柔比星(DOX)更有抵抗力。TUFM被发现是USP5的底物。USP5对TUFM进行了去泛素化,并提高了其在CRC细胞中的水平。强制表达TUFM能够缓解USP5敲除诱发的生长抑制。进一步分析表明,EBF转录因子1(EBF1)是USP5转录的主要调节因子,DOX抑制了CRC细胞中EBF1-USP5-TUFM轴。作者得出结论,USP5是CRC细胞的必需品,并促进其生长和对化疗药物的抗性。TUFM是USP5的去泛素化底物,介导USP5的细胞效应。USP5的转录受EBF1的调控。因此,针对EBF1-USP5-TUFM轴是一种潜在的治疗CRC的新策略。
研究内容
1.USP5调控结直肠癌细胞生长
为了确定参与CRC细胞生长的DUBs,利用表达各种针对DUBs的shRNA的慢病毒文库进行了高含量筛选(HCS)。针对USP5的shRNA明显减少了GFP的荧光,这是该筛选系统中细胞生长的指标。为了验证这一结果,用3种不同的慢病毒感染HCT116细胞,分别表达USP5靶向的shRNA#1、shRNA#2和shRNA#3。它们都明显减少了细胞的生长,降低了USP5的水平,同时伴随着Cyclin D1的下调。与这些结果一致,强制表达野生型USP5可以促进细胞生长,并降低多柔比星(DOX)对CRC细胞的药物敏感性,而表达催化不活跃的USP5突变体(USP5-C335A)没有影响。
作者随后检查了USP5敲除是否影响体内的肿瘤生长。将表达shUSP5#3或shNC的HCT116细胞皮下接种到裸鼠体内。USP5敲除明显减缓了异种移植的肿瘤生长且USP5和Cyclin D1的水平都明显低于对照组。

研究结论:USP5是CRC细胞生长的一个重要调节器。
2.原发性结直肠癌中USP5表达增加
作者发现,在公共的GEPIA RNAseq数据库中,USP5在结直肠腺癌中的表达明显高于正常对照。作者通过qRT-PCR评估了二十四对CRC组织和非癌症组织中的USP5 mRNA水平。除一对组织(#16)外,其他组织中的USP5 mRNA都明显偏高。作者还能通过免疫印迹法检查一些CRC细胞系中的USP5表达。与正常组织相比,USP5蛋白在CRC细胞系中高度表达。另一方面,USP5的表达水平与CRC的临床分期相关,第四期肿瘤的USP5水平最高。此外,表达高水平USP5的CRC患者的总生存期明显短于表达低水平USP5的患者,表明USP5的水平是CRC患者的一个信息性预后因素。
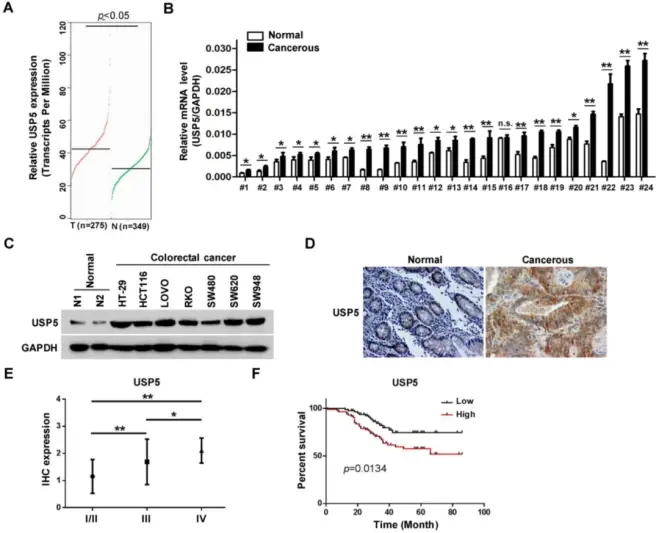
研究结论:原发性结直肠癌中USP5表达增加。
3.USP5与TUFM相互作用
为了探索USP5如何影响CRC细胞的生长,作者在HEK293T细胞中表达了Myc-USP5,并用抗Myc抗体拉下USP5。对拉下来的蛋白进行质谱分析,发现TUFM的12个独特肽。为了证实它们的相互作用,用表达Myc-USP5和Flag-TUFM的质粒转染细胞,进行相互共免疫沉淀试验,实验发现抗Myc或抗Flag抗体分别使TUFM或USP5下降。此外,抗USP5和抗TUFM抗体能够分别免疫沉淀HCT116细胞中的内源性TUFM和USP5,表明这两种蛋白在CRC细胞中相互作用。从GEPIA数据库中也可以发现,USP5和TUFM的表达在CRCs中高度相关(R=0.5),表明它们的相互作用可能在原发性CRCs中发挥重要作用。
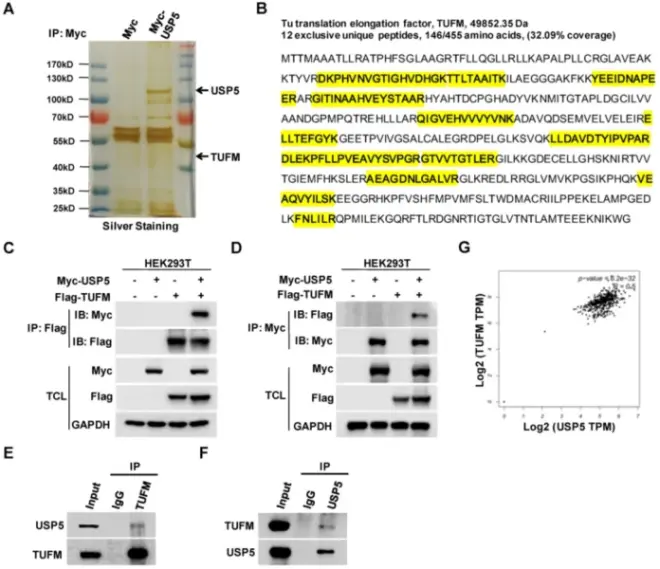
研究结论:USP5与TUFM发生相互作用。
4.USP5通过泛素-蛋白体途径稳定TUFM
为了研究USP5是否可以作为DUB来影响TUFM的泛素化状态,作者在HEK293T细胞中共同转染了野生型USP5(USP5-WT)或突变型USP5(USP5-C335A)和TUFM的质粒,并通过免疫印迹检查其蛋白水平。实验发现,USP5-WT的表达增加导致细胞中TUFM水平的剂量依赖性升高,而通过shRNAs敲除USP5导致TUFM的减少。另一方面,USP5的无活性突变体不能增加外源性和内源性TUFM的表达水平。
此外,在CHX追赶试验中,随着USP5的强制表达,TUFM的半衰期明显延长。在暴露于蛋白酶体抑制剂MG132之后,3种不同的CRC细胞中TUFM的水平增加,而MG132在很大程度上阻止了USP5敲除后HCT116细胞中TUFM的减少。这些结果表明,TUFM的蛋白酶体降解受到细胞中USP5去泛素化作用的正向调节。
作者进一步检查了TUFM的泛素化状态。在转染了表达Flag-TUFM和Myc-Ub的质粒的HEK293T细胞中,免疫沉淀的TUFM被严重泛素化。当野生型USP5也被共同转染到该系统中时,TUFM泛素化明显减少。此外,敲除USP5增强了TUFM的泛素化。

研究结论:USP5直接使TUFM泛素化并增加其稳定性。
5.TUFM调节结直肠癌细胞生长并受USP5调节
受USP5调控 TUFM是一种线粒体蛋白,广泛表达于不同组织,包括结肠。这与之前的研究一致,公共癌症数据库TCGA显示,TUFM在CRC肿瘤中高表达。8对有代表性的肿瘤组织进行了针对TUFM和USP5的免疫印迹分析。TUFM和USP5在CRC组织中都是高表达的。
此外,TUFM的过表达或敲除促进或抑制了CRC细胞的生长,并调节了Cyclin D1的表达,而过表达的TUFM逆转了shUSP5诱导的细胞生长抑制和Cyclin D1下调。作者还使用了小分子USP5抑制剂WP1130。它可以剂量依赖地下调TUFM的表达。

研究结论:TUFM调节结直肠癌细胞的生长,并受USP5的调节。
6.EBF1调控USP5的表达
USP5对CRC细胞生长的影响促使作者通过使用USP5启动子区域的不同片段驱动的荧光素酶报告来研究USP5的表达调节。含有-230/+32片段的构建体表达了高水平的荧光素酶活性。进一步分析发现,该区域包含转录因子的推定结合位点,包括E2F1、E2F4、E2F6、EBF1、FOXC1、KLF5、SP1和TFAP2C。在HCT116中用siRNAs单独沉默后,作者发现只有EBF1被敲除后才会明显下调USP5。这一结果被进一步验证,因为有更多针对EBF1的siRNA,并且发现过表达的EBF1促进了USP5的表达。用抗EBF1抗体进行的CHIP检测也表明,EBF1直接与USP5启动子结合。

研究结论:EBF1是USP5表达的一个重要调节器。
7.阿霉素抑制结直肠癌细胞的EBF1-USP5-TUFM轴
USP5在CRC细胞生长中的重要作用促使作者研究其表达是否参与了化疗药物的抗肿瘤作用。抗癌药物阿霉素(DOX)明显抑制了CRC细胞中USP5启动子驱动的荧光素酶活性,并降低了USP5 mRNA水平。然后作者通过免疫印迹法检查DOX对EBF1和TUFM表达的影响。除了USP5的表达减少外,DOX还能诱导HCT116和RKO细胞中EBF1和TUFM的减少。

研究结论:抗癌药物阿霉素明显抑制了EBF1-USP5-TUFM轴。
结论与讨论
在本研究中,作者表明USP5对结直肠癌细胞在培养和小鼠体内的生长很重要。它使CRC细胞对化疗药物更有抵抗力,并在许多原发性CRC组织中高度表达,这与CRC患者的疾病分期和总生存率相关。TUFM被确定为USP5的底物,因此在蛋白质水平上受到USP5的调节。此外,强制表达TUFM能够减轻USP5敲除诱导的生长抑制,表明它是USP5在CRC细胞中作用的一个重要媒介。此外,作者发现EBF转录因子1 (EBF1)是USP5转录的主要调节因子。这些结果表明,EBF1-USP5-TUFM轴可能是治疗CRC的新靶点。
Thank you!
原文链接:https://www.thno.org/v09p4208.htm

