双免疫组合及双抗在胆道肿瘤的切入点及布局失误(最新幻灯分享)


——胆道恶性肿瘤免疫治疗研究汇总——
# IMMUCHEC研究 转移性BTC 度伐利尤单抗+Tremelimumab+化疗

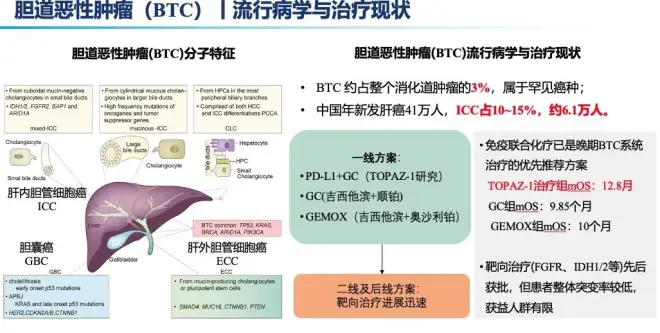
D+T的双免组合方案在肝癌获得成功,在胆道恶性肿瘤领域也有研究布局。
Topaz-1是第一个证明PD-L1抑制剂度伐利尤单抗(D)联合吉西他滨(Gem)和顺铂(Cis)相较于吉西他滨和顺铂,在晚期BTC(胆道恶性肿瘤)有效的III期临床研究。并且,该组合方案有望成为BTC患者的新的一线治疗标准。
IMMUCHEC研究的目的是评估tremelimumab(两种给药方案)与CTx+D联合使用的疗效。
IMMUCHEC研究是一项前瞻性、随机、多中心Ⅱ期“概念验证性研究(proof-of-concept study)”,在德国16家中心纳入了138例患者以评估曲美木单抗(T)和度伐利尤单抗(D)联合化疗疗效,纳入成人、ECOG 0~1、病理确诊的转移性BTC或胆囊癌。主要研究终点是依据RECIST1.1评估的初治患者的ORR;次要终点是OS、PFS和安全性;探索性分析包括试验治疗组的综合疗效和安全性分析。

研究分为5组探索二个剂量和用法的T和D+吉西他滨单药或CisGem方案的疗效及安全性。设计的是非常复杂的,但确实符合BTC临床治疗需要和目前流行的消化道肿瘤免疫检查点抑制剂联合化疗的研究设计思路。我们简化下各个药物的用药剂量和周期,具体罗列如下:
度伐利尤单抗:1500mg Q3W 治疗直至进展或终止;
曲西木单抗:Arm A+B, 75 mg Q3W,最多4个周期; Arm D, 300mg单次(C1D1);
吉西他滨:1000mg/m2 D1+D8,Q3W; Arm A+B+D+E,最多8周期;Arm C, 研究者决定治疗最大周期;
顺铂:25mg/m2 D1+D8,Q3W Arm B+D+E,最多8周期;Arm C, 研究者决定治疗最大周期。
细化到各个组,如下:
队列A:D 1.5g Q3W + 4x T 75 mg Q3W + Gem 1000mg/m2;
队列B:D 1.5g Q3W + 4x T 75 mg Q3W + Gem 1000mg/m2 +Cis 25mg/m2;
队列C:Gem+Cis的控制治疗
队列D:D 1.5g,Q3W + 1次推注T 300 mg+Gem+Cis
队列E:D 1.5g Q3W + Gem + Cis
我们重点观察下D组,剂量和用法为:Tremelimumab 300mg×1次剂量+度伐利尤单抗 1500mg Q3W+化疗;肝癌HIMALAYA研究的T300+D(STRIDE组):Tremelimumab 300mg×1次剂量+度伐利尤单抗 1500mg Q4W。
ORR、mPFS、mOS结果如下:

历史对照

结论
无论是度伐利尤单抗单药还是联合曲美木单抗和化疗对比化疗一线治疗BTC均未能提升ORR,IMMUCHEC研究未达到预定的ORR终点,足见CisGem方案做为标准的一线治疗在晚期BTC治疗中的地位还是非常稳固的;
D组相较于单纯化疗的C组,PFS也不具有优势。分别为:8.13m 和 8.7m;
OS方面,显示出获益趋势,D组达到了22.73m,单纯化疗组为16.93m。
CA209-538 亚组分析结果:纳武利尤单抗+伊匹木单抗治疗胆管癌
研究方法
CA209-538研究是一项前瞻性多中心II期非随机临床研究(NCT02923934),纳入包括胆道癌在内的晚期罕见癌症患者,研究纳入3个队列(罕见上消化道肿瘤、罕见妇科肿瘤和神经内分泌肿瘤)。入组患者接受纳武利尤单抗(3mg/kg)+伊匹木单抗治疗(1mg/kg)(Q3W)4个周期,序贯纳武利尤单抗(3mg/kg,Q2W)治疗直至疾病进展。主要终点为DCR。
研究结果
2017年12月至2019年12月期间,39例晚期BTC患者纳入CA209-538研究,大多数患者(n=33)在一个或多个治疗线后经历了疾病进展,并且肿瘤组织可用于生物标志物研究。

整个队列的ORR为23%(9/39),8例患者达到SD,DCR为44%。胆囊癌患者的ORR为31%(4/13),肝内胆管癌患者的ORR为31%(5/16),10例肝外胆管癌患者未见任何反应。
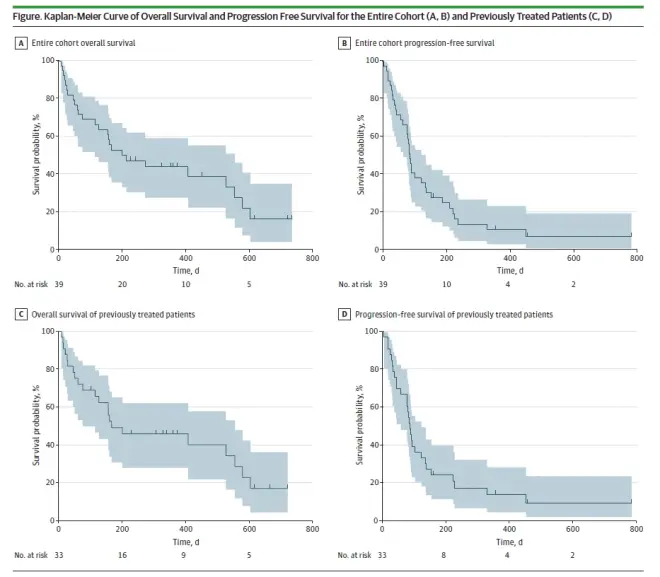
33例经治患者的ORR为27%,中位PFS:2.9个月(95%CI,2.2-4.6个月),中位OS:5.4个月(95%CI,2.7-11.9个月)。两例持续缓解患者随后接受了残留灶的手术切除,且在最后随访中无复发。
49%的患者(n=19)报告了免疫相关毒性事件,其中15%(n=6)经历了3级或4级事件。
研究结论
本次CA209-538试验的亚组分析是首次评估O+Y联合免疫治疗晚期胆道癌患者的疗效;
该方案与胆囊癌和肝内胆管癌患者的临床结果显著改善相关,导致持久的反应;这与化疗获得的一般短暂反应形成对比。
PD-1/CTLA-4双抗尝试二线治疗恶性胆道肿瘤的尴尬


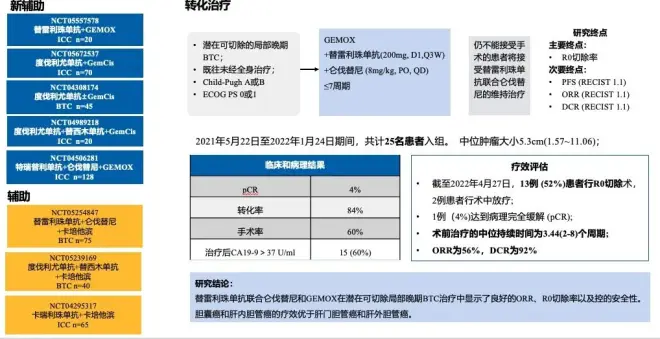
这是一项单臂II期临床试验,旨在评估XmAb20717在晚期胆道癌患者中的疗效,这些患者对基于吉西他滨的化疗方案有进展或不耐受。从clinicaltrial.gov来看,这项研究是2022年开始启动,那早有布局肯定是在2022年以前。原本是敢为人先的医学创新设计。毕竟相较于PD-1单抗,PD-1/CTLA-4双抗自带的历史使命肯定是要在PD-1抗体尚未解决的临床难治性癌种上进行尝试。选择难治性的BTC进行二线挑战,是符合伦理也是值得鼓励的。但时代变迁,标准治疗也出现了改变。随着TOPAZ-1及Keynote966研究的相继成功。目前,BTC晚期一线系统治疗的标准方案已经改写为PD- L1抗体联合化疗、PD-1抗体联合化疗。此时,XmAb20717(PD-1/CTLA-4双抗)单药布局一线化疗进展的二线患者,意义何在?或者说的商业味道浓一些,生意来源于哪里?此时无论从商业角度还是从伦理角度,应该进行两种选择,一种是也纳入一线用过免疫的BTC患者,尝试免疫再挑战,不过失败的风险很大;第二种方式就是新开一项研究,PD-1/CTLA-4双抗联合化疗,成功的可能性更大一些。
最后附上2017 SITC大会上公布的具体的作用机制,粗看了一下,也强调了double positive TILs,即共表达PD-1、CTLA-4的肿瘤浸润淋巴细胞能够驻留更长时间的PD-1/CTLA-4双抗。这一点,阿斯利康的MEDI5752以及双抗的卡度尼利单抗机制都是如此,看来是PD-1/CTLA-4双抗的独特机制。






